Теоретическая часть:
Органическая химия изучает соединения углерода. Соединения углерода содержатся во всех животных и растительных организмах, от чего и произошло их название – органические.
Электронная природа химических связей в молекулах органических соединений.
Атом углерода образует только ковалентные связи, т.к. электроотрицательность (ЭО) атома углерода занимает промежуточное положение между значениями ЭО типичных металлов и типичных неметаллов.
6С 1s22s22p2 C* 1s22s12р3







 hn
hn
 n =2 2р
n =2 2р
2s
основное состояние возбужденное состояние (С*)
валентность II валентность IV
Основное (устойчивое) состояние атома – это такое состояние, которое характеризуется минимальной энергией.
Возбуждение – это переход электронов на более высокий подуровень в пределах одного уровня; состояние с более высокой энергией.
В возбужденных атомах неспаренные электроны находятся на разных подуровнях, и, следовательно, орбитали этих электронов различаются по энергии и по форме. Однако, ковалентные связи, которые образуют эти электроны, являются равноценными. Это объясняется явлением, которое называется гибридизацией орбиталей.
Гибридизация атомных орбиталей – это процесс взаимодействия и смешения близких по энергии и разных по форме атомных орбиталей, в результате которого образуются одинаковые по форме и энергии гибридные орбитали.
Наиболее важные типы гибридизации орбиталей: sp, sp2,sp3.
Ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов, называются сигма-связями (s). Одинарные связи всегда являются s-связями.
s 




 s s
s s
s s s р р р
|
|
p-связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.


 А = В
А = В
А º В
р р
Генетические связи между классами углеводородов
Между классами УВ существуют генетические (родственные) связи: представители одних классов могут быть превращены в вещества, относящиеся к другим классам. Эту взаимосвязь можно отобразить при помощи схемы:
- Н2 - Н2



 алканы алкены алкины
алканы алкены алкины
 |
- Н2 + Н2
алкадиены
Классификация реакций в органической химии
1) по числу и составу реагирующих веществ
| Реакции присоединения | Реакции отщепления | Реакции замещения |
| галогенирование, гидрирование, гидрогалогенирование и т.д. частный случай – полимеризация СН2 = СН2 + НСl ®СН3 – СН2 - Сl | дегидрирование, дегидратация и т.д. t0 СН3 –СН3 ® СН2 = СН2 + Н2 | галогенирование, нитрование, гидролиз и т.д. hn СН4 + Сl2 ® СН3Сl +НСl |
2) по механизму протекания реакции
| Гомолитические реакции | Гетеролитические реакции |
| Идущие с образованием свободных радикалов А: В ® А× + ×В | Идущие с образованием ионов А: В ® А+ +:В- |
Физико-химические характеристики углеводородов
| Классы углеводородов | Вид гибридизации | Вид связи | Длина связи, нм | Общая формула гомологического ряда |
| Алканы С – С Алкены С =С Алкины С º С | sp3 sp2 sр | s s + p s + p | 0,154 0,134 0,120 | СnH2n+2 СnH2n СnH2n-2 |
|
|
Изомерия
1. Изомерия цепи (изомерия углеродного скелета) характерна для всех классов органических соединений.
Например, изомерами являются:
СН3 – СН2 – СН2 – СН2 – СН3 пентан
СН3 – СН – СН2 – СН3 2-метилбутан
½
СН3
СН3
½
СН3 – С – СН3 2,2-диметилпропан
½
СН3
2. Изомерия положения кратной связи в молекуле характерна для соединений с кратными связями – двойными и тройными.
Например, изомерами являются:
СН2 = СН – СН2 – СН3 бутен-1
СН2 – СН = СН – СН3 бутен-2
3. Изомерия положения функциональной группы характерна для соединений с функциональными группами – аминогруппой, гидроксильной группой и пр.
Например, изомерами являются:
СН3 – СН2 – СН2 –ОН пропанол-1
СН3 – СН – СН3 пропанол-2
½
ОН
4. Пространственная изомерия (или стереоизомерия) характерна для непредельных соединений, в составе которых имеются атомы или группы атомов, способные занимать различное положение в пространстве.
Например, изомерами являются:

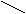

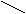 СН3 СН3 Н СН3
СН3 СН3 Н СН3



 С = С С = С
С = С С = С
Н Н СН3 Н
Цис-бутен-2 Транс-бутен-2
5. Изомерия заместителей в бензольном кольце характерна для органических соединений, в молекулах которых имеется бензольное кольцо
Например, изомерами являются:
СН3 СН3 СН3

 ½ СН3 ½ ½
½ СН3 ½ ½
 |  | ||||
 | |||||



СН3 ½
СН3
орто-ксилол мета-ксилол пара-ксилол
6. Межклассовая изомерия. Изомеры относятся к разным классам органических соединений.
Например, изомерами являются:
СН º С – СН2 – СН3 бутин-1
СН2 = С = СН – СН3 бутадиен-1,2
Алканы