Полимеры (ВМС) – это вещества с очень большой молекулярной массой, молекулы которых содержат повторяющиеся группировки атомов.
Мономеры – низкомолекулярные вещества, из которых образуются молекулы полимеров.
 Структурное звено полимера – группа атомов, многократно повторяющаяся в макромолекуле полимера.
Структурное звено полимера – группа атомов, многократно повторяющаяся в макромолекуле полимера.
СН2 = СН2 + СН2 = СН2 + … 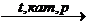 (-СН2 – СН2 – СН2 -)n
(-СН2 – СН2 – СН2 -)n
этилен (мономер) структурное звено
полиэтилен (полимер)
n – степень полимеризации
СН2 = СН – СН3 + СН2 = СН – СН3 + … 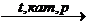 (- СН2 – СН –СН2 – СН -)n
(- СН2 – СН –СН2 – СН -)n
½ ½
CH3 CH3
пропилен полипропилен
Алкадиены
Общая формула, номенклатура
Алкадиены – это ациклические непредельные углеводороды с общей формулой СnН2n-2, в молекулах которых содержится две двойные связи.
Названия алкадиенов образуются от названий соответствующих алканов с помощью замены –ан на –диен: пропадиен, бутадиен – 1,3; бутадиен – 1,2. Цифрами указываются номера атомов, у которых начинается двойная связь. Характерна изомерия углеродного скелета, изомерия положения двойных связей, геометрическая (цис-, транс-) изомерия, межклассовая изомерия (с алкинами).
Строение молекул
Атомы углерода – в состоянии sp2 гибридизации. Гибридные облака – под углом 1200. Молекулы алкадиенов имеют плоское строение.
Двойные связи могут быть изолированными (через несколько одинарных связей), например СН2 = СН –СН2 – СН = СН2 пентадиен – 1,4; сопряженными (через одну одинарную связь) СН2 = СН – СН = СН2 бутадиен – 1,3,
СН2 = С – СН = СН2 2-метилбутадиен – 1,3 (изопрен); кумулированными
½
СН3
(находящимися рядом) СН2 = С = СН2 пропадиен
Химические свойства
1) Реакции присоединения
а) галогенирование
СН2 = СН – СН = СН2 + СI2 ® CН2СI – CH = CH – CH2CI
|
|
CН2СI – CH = CH – CH2CI + CI2 ® CН2СI – CHCI – CHCI – CH2CI
б) гидрирование
СН2 = СН – СН = СН2 + Н2 ® СН3 – СН = СН – СН3
СН3 – СН = СН – СН3 + Н2 ® СН3 – СН2 – СН2 – СН3
в) гидрогалогенирование
СН2 = СН – СН = СН2 + НСI ® CH3 – CH = CH – CH2CI
CH3 – CH = CH – CH2CI + HCI ® CH3 – CHCI – CH2 – CH2CI
г) полимеризация
n СН2 = СН – СН = СН2 ® (-СН2 – СН = СН – СН2-)n
2) Реакция горения
2 СН2 = СН – СН = СН2 + 11О2 ® 8СО2 + 6Н2О
Получение
1) Дегидрирование алканов
СН3 – СН2 – СН2 – СН3 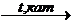 СН2 = СН – СН = СН2 + 2Н2
СН2 = СН – СН = СН2 + 2Н2
2) Дегидрирование и дегидратация спиртов (метод Лебедева)
2 СН3 – СН2ОН ® СН2 = СН – СН = СН2 + 2Н2О + Н2
Применение
Получение синтетического каучука и резины. Изопрен (2-метилбутадиен – 1,3) является мономером, при полимеризации которого образуется природный каучук.
Каучуки – продукты полимеризации диеновых углеводородов с сопряженными связями.
Состав (С5Н8)n n = 1000 –3000. Мономер натурального каучука – изопрен.
n (СН2 = С – СН = СН2) 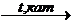 (- CH2 – C = CH – CH2 -)n
(- CH2 – C = CH – CH2 -)n
½ ½
CH3 CH3 полиизопрен
-Н2С СН2 - -Н2С Н
С = С С = С
Н3С Н Н3С СН2-
Цис-изомер Транс-изомер
Синтетический каучук получают по способу С.В.Лебедева. Мономер синтетического каучука – бутадиен – 1,3.
n СН2 = СН – СН = СН2 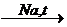 (- СН2 – СН = СН – СН2 -) n
(- СН2 – СН = СН – СН2 -) n
полибутадиен
-Н2С СН2- -Н2С Н
С = С С = С
Н Н Н СН2-
Цис-изомер Транс-изомер
Резина – вулканизированный каучук. Каучук обрабатывают серой или серусодержащими соединениями, в результате атомы серы присоединяются к линейным молекулам каучука по месту двойных связей и как бы сшивают молекулы друг с другом. В результате липкий и непрочный каучук превращается в упругую и эластичную резину.
|
|
S
½
-СН2 – СН – СН – СН2 –
½
S
½
S
½
-CН2 – СН – СН – СН2 –
½
S
Волокна – ВМС природного и синтетического происхождения, перерабатываемые в нити; характеризуются высокой упорядоченностью молекул (линейные полимеры).
Классификация волокон
Природные Химические
животного растительного искусственные синтетическое
происхождения происхождения продукты полимеры,
(шерсть, шелк) (хлопок, лен, пенька) переработки образуемые из
природных низкомолекуляр-
полимеров ных веществ
(вискозное, (полиамиды,
ацетатное) полиэфиры).
Ацетатное волокно
 ОН О О
ОН О О
С6Н7О2 ОН + 3n СН3 – С-О – С – СН3 ®
ОН
целлюлоза n уксусный ангидрид
 |
О-СО-СН3
® 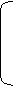 С6Н7О2 О-СО-СН3 + 3n СН3СООН
С6Н7О2 О-СО-СН3 + 3n СН3СООН
О-СО-СН3 n
Триацетилцеллюлоза
Алкины
Общая формула, номенклатура.
Алкины – это ациклические непредельные углеводороды с общей формулой СnH2n-2, в молекулах которых содержится одна тройная связь.
Названия алкинов образуются от названий от названий соответствующих алканов с помощью замены окончания –ан на –ин: этин(ацетилен), пропин, бутин-1, бутин-2. Цифрой указывается номер атома, у которого начинается тройная связь.
Для алкинов характерна изомерия углеродного скелета, изомерия положения тройной связи, межклассовая изомерия (с алкадиенами).
Строение молекул.
Атомы углерода при тройной связи – в состоянии sp-гибридизации. Гибридные облака – под углом 1800. Длина связи С º С 0,120 нм. Молекулы алкинов имеют линейное строение.
В молекуле этина два гибридных облака каждого атома углерода образуют s - связи, а оставшиеся р - электронные облака перекрываются, образуя p-связи, находящиеся в перпендикулярных плоскостях.
|
|
Химические свойства.
1)Реакции присоединения
а) галогенирование
СН º СН + СI2 ® СНСI = СНСI
СНСI = СНСI + CI2 ® СНСI2 – СНСI2
б) гидрирование
СН º СН + Н2 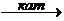 СН2 = СН2
СН2 = СН2
СН2 = СН2 + Н2 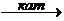 СН3 – СН3
СН3 – СН3
в) гидрогалогенирование
СН º СН + НСI ® СН2 = СНСI
СН2 = СНСI + НСI ® СН3 – СНСI2
СН3 – С º СН + НСI ® CН3 – ССI = СН2 (присоединение по правилу Марковникова – водород присоединяется к наиболее гидрогенизированному атому углерода при тройной связи)
 г) тримеризация
г) тримеризация
 3 СН º СН
3 СН º СН 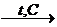
д) гидратация (реакция Кучерова) О
СН º СН + НОН 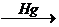 СН3 – С
СН3 – С
Н
СН3 – С º СН + НОН 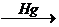 СН3 – С – СН3
СН3 – С – СН3
О
2) Реакция замещения атомов водорода при тройной связи
СН º СН + 2Na 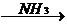 CNa º CNa
CNa º CNa
3) Реакция горения
2 СН º СН + 5О2 = 4СО2 + 2Н2О
4) Реакция разложения при нагревании
СН º СН 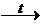 Н2 + 2С
Н2 + 2С
Получение
1) Карбидный метод
СаС2 + 2Н2О = С2Н2 + Са(ОН)2
2) Дегидрирование алканов
2СН4 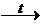 С2Н2 + 3Н2
С2Н2 + 3Н2
На производстве ацетилен получают из природного газа и нефти.