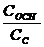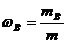 - массовая доля растворенного вещества, выражается в долях от единицы
- массовая доля растворенного вещества, выражается в долях от единицы
m в – масса растворенного вещества
m – общая масса раствора
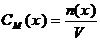 - молярная концентрация или молярность (частиц (x)), моль/л
- молярная концентрация или молярность (частиц (x)), моль/л
n(x) – количество вещества частиц x, содержащихся в растворе, моль
V – объем раствора, л
Раствор, в 1 литре которого содержится 1 моль растворенного вещества, называется молярным. Обозначается буквой М.
Например, 1М NаОН – молярный раствор: 1л раствора содержит 1 моль вещества или 1 моль × 40 г/моль = 40 г NаОН
Растворимость – это свойство вещества растворяться в воде или в другом растворителе.
Насыщенный раствор – это такой раствор, который находится в динамическом равновесии с избытком растворенного вещества.
Коэффициент растворимости или растворимость вещества выражается максимальным числом граммов вещества, которое можно растворить в 100 г растворителя при данной температуре.
Электролиты и неэлектролиты
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами (кислоты, основания и почти все соли).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами (большинство органических соединений и вещества с неполярными и малополярными ковалентными связями).
Распад электролитов при растворении их в воде называется электролитической диссоциацией.
NaCl в воде: NaCl «Na+ + Cl-
хлорид ион ион
натрия натрия хлора
Теория электролитической диссоциации
I.Электролиты при растворении в воде распадаются (диссоциируют) на ионы –
положительные и отрицательные.
ионы простые (Na+, Mg2+, Al3+)
сложные (NO3-, SO42-, РО43-)
|
|
II. Под действием электрического тока ионы приобретают направленное движение:
положительно заряженные (катионы) ® к катоду,
отрицательно заряженные (анионы) ® к аноду.
III. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация)
КА «К+ + А-
Диссоциация кислот, оснований и солей в водных растворах
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
НСl «Н+ + Сl-
СН3СООН «Н+ + СН3СОО-
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации.
НСl – одноосновная, Н2S – двухосновная, Н3РО4 – трехосновная.
Диссоциируют ступенчато двух- и многоосновные кислоты:
Н3РО4 «Н+ + Н2РО4- (1 ступень)
Н2РО4- «Н+ + НРО2-4 (2 ступень)
НРО2-4 «Н+ + РО3-4 (3 ступень)
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
КОН «К+ + ОН-
NН4ОН «NН4+ + ОН-
Основания, растворимые в воде, называются щелочами – это основания щелочных и щелочноземельных металлов.
Кислотность основания определяется числом гидроксильных групп (гидроксогрупп).
NН4ОН – однокислотное, Са(ОН)2 – двухкислотное, Fе(ОН)3 – трехкислотное.
Амфотерные электролиты при диссоциации образуют одновременно катионы водорода и гидроксид-ионы (вода, гидроксиды Zn, Al,Cr …)
Zn2+ + 2OH- «Zn(OH)2 + 2H2O «[Zn(OH)4]2- + 2Н+
Солями называются электролиты, при диссоциации которых образуются катионы металлов (а также катионы аммония NН4+) и анионы кислотных остатков.
|
|
NaCl ↔ Na+ + Cl-
Степень диссоциации
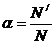 , где
, где
a - степень диссоциации; выражается в долях от единицы или в %.
N / - число распавшихся на ионы молекул
N – общее число молекул вещества, внесенных в раствор
Сильные электролиты при растворении в воде полностью диссоциируют на ионы, к ним относятся:
1. Почти все соли
2. Многие минеральные кислоты, например: Н2SО4, НNО3, НСl, НВr …
3. Основания щелочных и щелочноземельных металлов (щелочи)
Слабые электролиты при растворении в воде частично диссоциируют на ионы, к ним относятся:
1. Почти все органические кислоты
2. Некоторые минеральные кислоты, например: Н2СО3, Н2S, НNО2, НСlО …
3. Многие основания металлов (не щелочи), а также NН4ОН, вода
Рассмотрим диссоциацию слабого электролита: СН3СООН↔ Н+ + СН3СОО-
Уравнение реакции показывает, что между недиссоциированной частью молекул и ионами установилось равновесие, которое можно выразить следующим образом:
К = [H+] [CH3COO-] / [CH3COOH]
В этом случае константа равновесия характеризует диссоциацию вещества в растворе и носит название константы диссоциации.
Константа диссоциации зависит от температуры, но не зависит от концентрации, поэтому является более общей характеристикой электролита, чем степень диссоциации.
Между концентрацией электролита в растворе, его степенью и константой диссоциации существует зависимость
К = С λ2 / 1- λ;
В такой форме это уравнение выражает закон, известный под названием закона разбавления.
Для слабого электролита при небольших разбавлениях его степень диссоциации λ мала и величина 1- λ мало отличается от единицы. Следовательно, для этого случая можно писать: К ≈ С λ2 λ ≈ √ К/С;
|
|
Сильные электролиты закону действующих масс не подчиняются. У сильных электролитов, вследствие большого числа ионов, начинает заметно сказываться наличие электростатического взаимодействия ионов друг с другом, в результате каждый ион окружен «ионной атмосферой», состоящей из ионов противоположного заряда, что уменьшает его подвижность. Межионные силы влияют на все свойства электролита. Они понижают активность ионов, а последние в реакциях проявляют себя так, будто их концентрация меньше действительной. Для учета этого влияния вводят понятие активность.
Активностью иона или молекулы называется их концентрация, соответственно которой они действуют в химических реакциях.
Отношение активности к концентрации электролита называется коэффициентом активности ƒ = а/С, отсюда а = ƒ∙ С.
В разбавленных растворах слабых электролитов ƒ = 1, т.е. действия ионов не стеснены и а= С, поэтому в уравнении констант равновесия пишут обычно концентрации, а не активности ионов. Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые ионы из обеих частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения.
Пример: Написать ионно-молекулярное уравнение реакции взаимодействия между водными растворами FeCl3 и NaOH
1. Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl
2. полное ионное уравнение
Fe3+ + 3Cl- + 3Na+ + 3OH- = Fe(OH)3¯ + 3Na+ + 3Cl-
3. сокращенное ионное уравнение
Fe3+ + 3OH- = Fe(OH)3¯
¯ - выпадает в виде осадка
- удаляется в виде газа
Если в таких реакциях не происходит изменения зарядов ионов, то реакции
являются ионнообменными.
Вода – слабый электролит, и в незначительной части диссоциирует на ионы:
Н2О «Н+ + ОН-
Из уравнения электролитической диссоциации видно, что вода может проявлять и кислотные и основные свойства.
Произведение концентрации водородных и гидроксильных ионов, называемое ионным произведением воды (Кв), является величиной постоянной и при температуре 220С.
Кв = [Н+] [ОН-] = 10-14
Поскольку вода является идеальным амфолитом и посылает в раствор равное количество водородных и гидроксильных ионов, то их концентрация в чистой воде равна и составляет
[Н+] = [ОН-] = 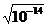 = 10-7 г-ион/л
= 10-7 г-ион/л
Концентрация [Н+] и [ОН-] являются сопряженными величинами, и понижение одной из этих величин в растворе какого-либо электролита влечет за собой увеличение другой величины. Поскольку пользоваться числами с отрицательными степенями неудобно, то были введены понятия водородного (рН) и гидроксильного (рОН) показателей.
Водородным показателем называется отрицательный десятичный логарифм концентрации (активности) ионов водорода
рН = - lg [Н+] (для разбавленных растворов)
рН = - lg a Н+ (для концентрированных растворов).
Гидроксильным показателем называется отрицательный десятичный логарифм концентрации (активности ионов гидроксила)
рОН = - lg [ОН-] (для разбавленных растворов)
рОН = - lg a ОН- (для концентрированных растворов).
Водородный и гидроксильный показатели связаны между собой уравнением:
рН + рОН = 14
Величиной рН удобно пользоваться для выражения реакции водных растворов.
Нейтральная среда: рН = рОН = 7;
Кислая среда: рН<7;
Щелочная среда рН > 7.
Методические рекомендации к теме.
Формулы для вычисления [H+] в растворах
Сильная кислота Сильное основание (щелочь)
[H+] = CN к-ты [OH-] = CN щел.
слабая кислота слабое основание
[H+] = 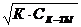 [OH-] =
[OH-] = 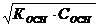
ацетат. буфер. р-р аммиач. буф. р-р
[H+] = Кд. к-ты 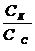 [OH-] = Косн
[OH-] = Косн