Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Например: 2 КСlО3 ® 2 КСl + 3 О2 (при нагревании)
бертолетова соль ® хлорид калия + кислород
Обратимыми называются реакции, которые одновременно протекают в двух взаимопротивоположных направлениях.
Например: 2/3 Н2 + ½ N2 «NН3 DН = -46,2 кДж/моль
водород + азот «аммиак
Необратимые реакции:
1. Образующиеся продукты уходят из сферы реакции:
а) выпадают в виде осадка
ВаСl2 + Н2SО4 ® ВаSО4¯ + 2НСl
б) выделяются в виде газа
Na2CO3 + 2HCl ® 2NaCl + CO2 + Н2О
2. Образуется малодиссоциированное соединение, например вода:
HCl + NaOH ® H2O + NaCl
3. Реакция сопровождается большим выделением энергии, например горение магния:
Mg + ½ O2 ® MgO DН = -602,5 кДж/моль
Химическое равновесие
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия: состояние системы реагирующих веществ, когда скорости прямой и обратной реакции равны.
Концентрации реагирующих веществ при химическом равновесии называются равновесными.
Они обозначаются: [Н2], [N2], [NН3].
Неравновесные концентрации обозначаются: 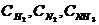 .
.
Принцип Ле-Шателье или принцип подвижного равновесия:
Если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие.
1) Увеличение температуры смещает равновесие в сторону охлаждения, т.е. усиливает ту реакцию, при которой теплота поглощается. Если прямая реакция – экзотермическая, то равновесие при нагревании смещается влево, а если прямая реакция – эндотермическая, то вправо. Уменьшение температуры смещает равновесие в сторону нагревания, т.е. усиливает экзотермическую реакцию.
2) Давление влияет только на обратимые газовые реакции, причем только на те из них, в которых происходит изменение общего числа молекул газа. Увеличение давления смещает равновесие в сторону уменьшения общего числа молекул газов, а уменьшение давления - в сторону увеличения числа молекул.
3) Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Увеличение концентрации исходных веществ и удаление продуктов реакции смещает равновесие в сторону прямой реакции.
4) Катализаторы не влияют на положение равновесия, а только ускоряют его установление.
Методические рекомендации к контрольному заданию № 6, №7.
Задача 1.
Как изменится скорость реакции окисления 2NO + O2 = 2NO2, если давление в системе возросло в три раза.
Решение:
До изменения давления кинетическое уравнение реакции по закону Гульдберга и Вааге имело вид: V = к·C2NO·CO2.
При увеличении давления в три раза возрастет концентрация каждого компонента и кинетическое уравнение будет иметь вид:
V = к·(3CNO)2·(3CO2) = 27к·C2NO·CO2.
При сопоставлении этих уравнений видно, что скорость реакции увеличилась в 27 раз.
Задача 2.
Определите, во сколько раз увеличится скорость реакции при повышении температуры от 10 до 500С, если температурный коэффициент реакции равен 3.
Решение:
Зависимость скорости реакции от температуры описывается правилом Вант-Гоффа.
При повышении температуры на 100С скорость большинства химических реакций увеличивается в 2-4 раза.
Это правило математически выражается следующей формулой:
u2 = u1 × g t2 – t1 / 10 = u1 × g D t/ 10,
где g - температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 100С; u1 – скорость реакции при температуре t1; u2 – скорость реакции при температуре t2.
u2 = u1 × g t2 – t1 / 10 = u1 × 34 = 81 u1; u2/u1 = 81
Ответ: при повышении температуры от 10 до 500С скорость реакции увеличивается в 81 раз, если температурный коэффициент реакции равен 3.
Задача 3.
Составить выражение константы равновесия и вычислить ее значение для реакции:
2SO2 (Г) + O2 (Г) = 2SO3 (Г),
если равновесные концентрации равны: [SO2] = 0,12 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,04 моль/л.
Решение:
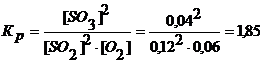
Задача 4.