Химическая связь – это силы, которые связывают отдельные атомы в молекулы.
Основной движущей силой, приводящей к образованию химической связи, является стремление атомов к завершению внешнего уровня, которое характеризуется наименьшим запасом энергии. Чем меньше запас энергии атома, тем более он устойчив в химическом отношении.
Типы химических связей:
1. Ковалентная связь
2. Ионная связь
3. Металлическая связь
4. Водородная связь
Ковалентная связь образуется между атомами с различной электроотрицательностью. Ковалентная связь – химическая связь, осуществляемая за счет общей пары электронов. Природа ковалентной связи заключается в образовании парой атомов общей электронной пары и совместном владении этой парой. За счет электронов этой пары каждый атом достраивает свой валентный уровень до завершенного и понижает, тем самым свою энергию. Благодаря удвоенной концентрации отрицательного заряда в области нахождения этой пары увеличивается притяжение между каждым из ядер и этой областью. Таким образом атомы оказываются связаны и удерживаются вместе.
Возможно два механизма образования ковалентной связи:
а) обменный механизм – связь образуется за счет спаривания электронов, принадлежащих разным атомам;
б) донорно-акцепторный механизм – связь образуется за счет электронной пары одного атома (донора) и вакантной орбитали другого (акцептора). Связь называется донорно-акцепторной или координационной.
 .. Н +
.. Н +
Н: N: Н + Н + ® Н: N: Н
Н Н
Ковалентная связь, образованная по донорно-акцепторному механизму, является менее прочной.
Ковалентная связь может быть полярной и неполярной.
Неполярная ковалентная связь – электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов (Н2; Сl2; О2; N2)
|
|
Н: Н
Полярная ковалентная связь – электронное облако связи смещено к атому с большей относительной электроотрицательностью (НСl; Н2О; Н2S и др.)
Н: Сl:
Изображение химической связи:
1. С помощью электронов в виде точек, поставленных у знака химического элемента
Н. + Н. ® Н: Н

 2. С помощью квантовых ячеек Н Н
2. С помощью квантовых ячеек Н Н


 + ® или
+ ® или
1s 1s
1s2
 Н2
Н2
3. В виде черточки, которая символизирует пару электронов: Н - Н
Свойства ковалентной связи:
1. Длина связи – это межъядерное расстояние.
2. Энергия связи – количество энергии, которое необходимо для разрыва связи; измеряется в кДж/моль.
3. Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Например: Н образует одну связь, С – не более четырех связей.
4. Направленность связи обуславливает пространственную структуру молекул, т.е. их геометрию (форму).
Способы перекрывания электронных облаков:
s -связь – перекрывание электронных облаков вдоль оси, соединяющей центры атомов.
p -связь – связь, возникающая между атомами, когда перекрывание электронных облаков происходит по обе стороны от линии, соединяющей ядра обоих атомов.
Гибридизация – выравнивание взаимодействующих орбиталей разных подуровней по форме и энергии. При этом расчетные формы новых орбиталей отличаются от исходных. Наиболее распространены следующие типы гибридизации:
1) sp3 –гибридизация. Одна s – орбиталь и три p- орбитали превращаются в четыре одинаковые гибридные орбитали, оси которых расположены под углом 109,280 друг к другу. Эти орбитали перекрываются с орбиталями других атомов и образуют ковалентные связи. sp3 –гибридизация имеет место в молекулах NH3, H2O и всех предельных углеводородов.
|
|
2) sp2 –гибридизация. Одна s –орбиталь и две p- орбитали превращаются в три одинаковые гибридные орбитали, расположенные под углом 1200 друг к другу. Этот вид гибридизации встречается в молекулах BF3, AlCl3, а также всех этиленовых и ароматических углеводородов.
3) sp- гибридизация. Одна s –орбиталь и одна p- орбиталь превращаются в две одинаковые гибридные орбитали, оси которых расположены под углом 180 0 друг к другу. Примеры: BeH2, BeF2, а также всех ацетиленовых углеводородов.
Соединения с ковалентной связью образуют молекулярные или атомные кристаллические решетки.
Ионная или электровалентная связь – химическая связь между ионами, осуществляемая электростатическим притяжением.
Образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности.
 Например: NaCl c(Nа) = 1,01 электроотрицательность
Например: NaCl c(Nа) = 1,01 электроотрицательность
c(Сl) = 2,85
 Nа 1s22s22p63s1 ® Na -
Nа 1s22s22p63s1 ® Na - 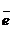 = Na+ ® Na+ 1s22s22p6 ионы
= Na+ ® Na+ 1s22s22p6 ионы
Cl 1s22s22p63s23p5 ® Cl + 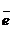 = Cl- ® Cl- 1s22s22p63s23p6
= Cl- ® Cl- 1s22s22p63s23p6
Na × + × Сl: = Na:Cl: и Na: Cl: = [Na+][Cl-]
Свойства ионной связи:
1) Ненаправленность. Каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного знака по любому направлению.
2) Ненасыщаемость. Взаимодействие ионов противоположного знака не приводит к компенсации силовых полей, способность притягивать по другим направлениям остается.
Металлическая связь – связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической решетке.
|
|
Наличие свободных электронов в решетке ® проводимость электричества и тепла, металлический блеск.
Ионы и атомы металла непосредственно не связаны, и их слои могут отдельно перемещаться относительно друг друга ® ковкость и пластичность металлов.
Водородная связь - связь между атомом водорода, соединенным с атомом сильно электроотрицательного элемента, одной молекулы и сильно электроотрицательными (F, O, N) элементами другой молекулы.
Возможно образование внутримолекулярной водородной связи. Обозначают точками …, так как связь в 15-20 раз слабее ковалентной.
Водородная связь оказывает влияние на свойства вещества, так как нужна дополнительная энергия для разрыва водородной связи.
Вода Уксусная кислота
Н ___ О … Н ___ О О …Н __ О
½ ½ СН3 ___ С С ___ СН3
Н Н О __ Н … О
(Н2О)2 (СН3СООН)2
Вещества, в которых образуется водородная связь между молекулами, отличаются повышенными температурами плавления и кипения.
Например, благодаря водородным связям, H2O при обычных условиях жидкость, H2S, H2Se, H2Te - газы; HF -жидкость, а HCl, HBr и HI -газы.