| Основные оксиды | Кислотные оксиды |
| 1. Взаимодействуют с водой Nа2О + Н2О = 2NаОН 2.Взаимодействуют с кислотами FeO + H2SO4 = FeSO4 + Н2О 3. Взаимодействуют с кислотными оксидами СаО + СО2 = СаСО3 | 1.Взаимодействуют с водой СО2 + Н2О = Н2СО3 2. Взаимодействуют с основаниями SO3 + 2NaOH = Na2SO4 +Н2О 3.Взаимодействуют с основными оксидами СаО + СО2 = СаСО3 |
| Амфотерные оксиды | |
| 1.С кислотами реагируют как основные оксиды ZnO + 2HCl = ZnCl2 + Н2О | 1.С основаниями реагируют как кислотные оксиды Al2O3 + 2NaOH = 2NaAlO2 +Н2О |
Получение оксидов:
1. Соединение простого вещества с кислородом (горение)
С + О2 = СО2; 4Li + O2 = 2Li2O
2. Горение сложных веществ
4СН3NН2 + 9О2 = 4СО2 + 2N2 + 10Н2О
3. Разложение при нагревании кислородных соединений: карбонатов, нитратов, гидроксидов
СаСО3 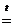 СаО + СО2
СаО + СО2
2Сu(NO3)2 =t 2 CuO + 4NO2 + О2
2Fe(OH)3 =t Fe2O3 + 3Н2О
Кислоты – электролиты, которые в воде диссоциируют на ионы водорода (катионы) и кислотные остатки (анионы).
| Кислородные НСl+7О4 – хлор ная кислота НСl+5О3 – хлорно ватая кислота НСl+3О2 – хлор истая кислота НСl+1О – хлорн оватистая кислота Название – от названия неметалла в зависимости от степени окисления: если степень окисления равна номеру группы, то окончание -ная, -вая; с уменьшением степени окисления -ватая; -истая; -оватистая. | Бескислородные НF – фтор оводородная кислота НСl – хлор оводородная кислота НВr – бром оводородная кислота НI – иод оводородная кислота Название: неметалл + о + водородная кислота |
Физические свойства кислот:
1. Кислоты: жидкие, твердые.
2. Многие хорошо растворимы в воде.
3. Растворы кислот ® кислый вкус.
4. Разъедают растительные и животные ткани.
5. Синий лакмус 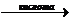 красный.
красный.
Химические свойства и способы получения кислот
|
|
| Химические свойства кислот | Получение кислот |
| 1. Взаимодействие с металлами, стоящими до водорода в электрохимическом ряду напряжений 2НСl + Fe = FeCl2 + Н2 | 1.Взаимодействие оксида неметалла с водой SO3 + H2O = H2SO4 |
| 2. Взаимодействие с основными оксидами Н2SO4 + CuO = CuSO4 + Н2О | 2. Взаимодействие соли с кислотой Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3¯ |
| 3. С солями Н2SO4 + K2SiO3 = H2SiO3¯ + K2SO4 | 3.Соединение водорода с неметаллом с последующим растворением в воде Н2 + Вr2 = 2HBr |
| 4. С основаниями Н2SO4 + 2 КОН = К2SO4 + 2 Н2О |
Гидроксиды
| Основания – электролиты, которые в воде диссоциируют на ионы металла (аммония в гидрате аммиака) и гидроксид-ионы. | Амфотерные гидроксиды при диссоциации образуют одновременно и катионы Н+, и гидроксид-ионы ОН-. |
| Название:гидроксид+название металла NаОН–гидроксид натрия Аl(ОН)3 – гидроксид алюминия | |
| Х и м и ч е с к и е с в о й с т в а | |
| 1. Взаимодействие с кислотами (реакция нейтрализации) | |
| КОН + НСl = КСl + Н2О 2. Взаимодействие с кислотными оксидами 2 NaOH + SiO2 = Na2SiO3 + Н2О 3. Взаимодействие с растворами солей 2КОН + СuSO4 = Cu(OH)2¯ + K2SO4 | Аl(ОН)3 + 3НСl = АlCl3 + 3Н2О 2. Взаимодействие со щелочами Al(OH)3 + NaOH = Na[Al(OH)4] |
Соли
Классификация солей:
1. Средние. Полное замещение атомов водорода кислоты на катион или группы -ОН на кислотный остаток. (Na2SO4 )
2NaOH + H2SO4 = Na2SO4 + 2Н2О
2. Основные. Неполное замещение гидроксогрупп (ОН) основания на кислотные остатки. (Mg(OH)Cl)
Mg(OH)2 + HCl = Mg(OH)Cl + Н2О
3. Кислые. Неполное замещение атомов водорода металлами. (NaHSO4 )
NaOH + H2SO4 = NaНSO4 + Н2О
4. Двойные. Состоят из ионов двух разных металлов и кислотного остатка.(КАl(SO4)2; (NH4)2Fe(SO4)2 )
|
|
5. Смешанные. Состоят из ионов одного металла и двух кислотных остатков.
(СаСl(OCl); Ca5(PO4)3F)
6. Комплексные. В состав входят сложные (комплексные) ионы. К4[Fe(CN)6])
Получение средних солей:
1) Реакция нейтрализации
КОН + НNО3 = КNО3 + Н2О
2) Кислоты с основными оксидами
H2SO4 + СuО = СuSO4 + Н2О
3) Кислоты с солями
Н2S + CuCl2 = CuS¯+ 2HCl
4) Соль с солью
Na2SO4 + ВаСl2 = ВаSO4¯ + 2NaCl
5) Основания с кислотными оксидами
Са(ОН)2 + СО2 = СаСО3¯ + Н2О
6) Щелочи с солями
3КОН + FeCl3 = КCl + Fe(ОН)3¯2
7) Основные оксиды с кислотными оксидами
СаО + SiO2 = СаSiO3
8) Металлы с неметаллами
2К + Cl2 = 2КCl
9) Металлы с кислотами
2Аl + 6НCl = 2АlCl3 +3Н2
10) Металлы с солями (см. электрохимический ряд напряжений металлов)
Fe + СuSO4 = FeSO4 + Сu