| Название | М О Л Е К У Л А | |||
| водорода | воды | аммиака | метана | |
| эмпирические формулы | Н2 | Н2О | NН3 | СН4 |
| электронные формулы | Н: Н | .. Н: О: Н | .. Н: N: Н | Н Н: С: Н Н |
| структурные формулы | Н - Н | Н - О - Н | Н __ N __ Н ï Н | Н ï Н __ С __ Н ï Н |
Валентность.
Валентность – способность атомов элемента образовывать химические связи.
Количественной мерой является число связей, образованных данным атомом с другими атомами или атомными группами.
Валентность химических элементов принято определять числом ковалентных связей, которыми данный атом соединен с другими атомами.
Валентность элементов определяется так же числом электронных пар, образующих химическую связь.
Примеры:
7N р Гидразин N2H4 Аммиак NН3



 n =2 H H Н
n =2 H H Н
N-3 Н
 n = 1 Азот N2 N-2 ___ N-2 Н
n = 1 Азот N2 N-2 ___ N-2 Н
N0 º N0 Н Н
Валентность азота равна 3.
Методические рекомендации по выполнению задания№4.
Для объяснения характера связей в молекуле отвечают, придерживаясь определенной последовательности.
План ответа:
1. Изображают графическую формулу соединения, где чертой обозначают связь между атомами.
2. Выписывают из таблицы значения электроотрицательностей “ c“ элементов образующих связь.
3. Рассчитывают значение разности электроотрицательностей элементов “Dc“.
Следует помнить, что при;
Dc = 0 возникает ковалентная неполярная связь;
Dc > 1,7 имеет место преимущественно ионная связь;
0< Dc< 1,7 образуется ковалентная полярная связь.
Соединение относится к числу ионных, если хотя бы одна связь в рассматриваемой молекуле носит ионный характер.
4. Для атомов образующих связь указывают строение электронной оболочки: полную и сокращенную электронные формулы, электронно-графическую формулу внешнего уровня.
|
|
5. Для объяснения образования молекулы по методу “ валентных связей ” приводят электронно - графические формулы образующих данную связь атомов, одну над другой. Волнистой линией показывают перекрывание неспаренных электронов этих атомов, отмечая антипараллельную направленность их спинов. Для ковалентных связей указывают их вид (сигма - s, пи - p): вид гибридизации центрального атома. Если имеет место, показывают возбужденное состояние, которое увеличивает валентные возможности атома. Это происходит в результате распаривания дублета электронов и перевода одного из них на более высокий подуровень в пределах одного уровня.
6. Указывают перекрывание орбиталей в пространстве, конфигурацию молекулы.
Типовое задание.
Объясните механизм образования и характер связи следующих соединений:
а) CsF; б) HCl; в) О2; г) CН4.
Ответ:
 а) CsF 1. графическая формула Cs F
а) CsF 1. графическая формула Cs F
2. электроотрицательность цезия - c (Cs) = 0,7; фтора - c (F) = 4,0.
3. разность электроотрицательностей Dc = 4,0 — 0,7 = 3,3, т. о. связь в рассматриваемой молекуле ионная.
4, 5, 6 пункты плана в случае ионной связи не рассматриваются.
 б) HCI 1. графическая формула H CI
б) HCI 1. графическая формула H CI
2. электроотрицательности: c (H) = 2,1;
c (CI) = 2,8.
3. разность электроотрицательностей Dc = 2,8 — 2,1 = 0,7, т. о. связь в молекуле ковалентная полярная.
 4. электронная формула H 1s1;
4. электронная формула H 1s1;
 электронно - графическая формула Н n=1;
электронно - графическая формула Н n=1;
электронная формула внешнего уровня атома хлора CI 3s23p5;
электронно - графическая формула
















n = 3
Согласно метода “ валентных связей” ковалентная связь возникает при перекрывании электронных облаков неспаренных электронов с антипараллельными спинами. Это изображают используя электронно - графические формулы атомов образующих связь:
|
|
















Cl n = 3
 |
 H n = 1
H n = 1
5. При перекрывании электронных облаков в пространстве в первую очередь реализуется s - связь. Это выглядит таким образом
Cl H
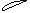
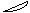
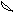
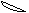
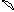
в) O2 1. графическая формула O = O
2. электроотрицательность c (O)= 3,5
3. разность электроотрицательностей Dc = 0, т. о. связь в молекуле ковалентная неполярная.
4. электронная формула полная O 1s22s22p4;
сокращенная [ He ]2s22p4;







 электронно-графическая
электронно-графическая

 n=2
n=2







 5. образование молекулы
5. образование молекулы

 O n=2
O n=2
 |


 O n=2
O n=2
6. перекрывание p -облаков в пространстве
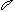
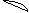
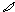
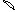
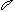
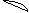
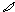
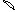 по оси X s - связь
по оси X s - связь
 |
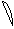
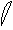
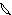
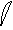
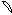
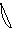
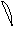
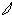
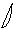
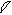 по оси Z p - связь
по оси Z p - связь
 |
Т. о. связь в молекуле O2 двойная, состоит из s и p связей.
г) CH4 1. графическая формула
 H
H

 H C H
H C H
 |
H
2. электроотрицательности: c (С) =2,5
c (H) =2,1
3. разность электроотрицательностей Dc =0,4, т. о. связь в молекуле ковалентная полярная.
4. электронная формула полная C 1s22s22p2;
сокращенная [ He ] 2s22p2;





 электронно-графическая
электронно-графическая

 n = 2
n = 2
электронная формула атома водорода H 1s1;
 электронно-графическая
электронно-графическая
 n = 1
n = 1
5. образование молекулы: у атома углерода реализуется четыре связи. Очевидно, сначала имеет место возбуждение и, как следствие его, возникновение четырех неспаренных электронов, затем происходит выравнивание электронных облаков по форме и по энергии, т. е. гибридизация. В данном случае sp3- гибридизация. Связи образуются вдоль осей, по которым направлены sp -гибридные облака углерода при перекрывании их с s -электронами атома водорода. Это будут четыре сигма связи. Форма молекулы — тетраэдр.
|
|
H H H H
 | |||||||
 |  |  | |||||
n = 1










 hn hn
hn hn














 n = 2 n = 2
n = 2 n = 2
С С* С
основное возбужденное гибридизованное
состояние состояние состояние
Контрольное задание№4.
Определите:
1. Характер химической связи между атомами в молекулах;
2. Тип гибридизации орбиталей центрального атома;
3. Наличие - и π- связей;
4. Изобразите схему перекрывания орбиталей и пространственную структуру молекул.
| Вариант | Молекулы | Вариант | Молекулы | Вариант | Молекулы |
| BeBr2, SiCl4; | BiH3, CdBr2; | H2Te, МgI2; | |||
| AlCl3, Cl2O; | AsH3, CO; | BI3, N2 | |||
| CdBr2, H2O2; | CO2, PCl3; | NH3 , F2 ; | |||
| C2H6, BeI2; | C2H6, BeI2; | Н2О, NaH | |||
| Br2, NaCl; | C2H2, SiH4; | BaCl2, H2; | |||
| KJ, F2; | NH3, F2 ; | СаО, Н2; | |||
| N2 , KCl; | Н2 , КJ; | BeF2 ,O2 ; | |||
| ZnCl2, COCl2; | BaCl2 , Н2; | ||||
| PH3, C2H4Cl2; | C2H6, BeI2; |