 Z = 8 Состав ядра:
Z = 8 Состав ядра:


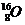 А = 16 8 протонов и
А = 16 8 протонов и
N = А – Z = 8 8 нейтронов
Разновидности атомов одного элемента, обладающие одинаковыми зарядами ядер, но разными массовыми числами называются изотопами. Изотопы содержат одинаковое число протонов и разное число нейтронов. В обозначении изотопов, порядковый номер элемента пишут слева внизу от символа изотопа, а массовое число слева вверху.
Пример: изотопы
кислорода О: 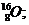
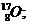
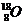
аргона Аr: 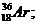
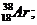
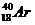
калия К: 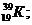
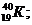
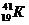
Атомная масса элемента равна среднему значению масс всех его природных изотопов с учетом их распространенности.
Например: природный хлор состоит из двух изотопов: 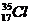 - с массовым долей - 0,754 (75,4%) и
- с массовым долей - 0,754 (75,4%) и 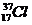 с массовой долей - 0,264 (24,6%).Это означает, что из 100 атомов природного хлора 75,4 являются изотопами
с массовой долей - 0,264 (24,6%).Это означает, что из 100 атомов природного хлора 75,4 являются изотопами 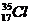 , а 24,6 – изотопами
, а 24,6 – изотопами 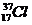 . Средние относительные атомные массы химических элементов определяются по формуле: Ar(среднее) = wат1 ×Ar(1) + wат2 ×Ar(2) + … wат(n ) ×Ar(n)
. Средние относительные атомные массы химических элементов определяются по формуле: Ar(среднее) = wат1 ×Ar(1) + wат2 ×Ar(2) + … wат(n ) ×Ar(n)
Средняя относительная атомная масса хлора равна:
Ar(С1) = 0,754 × 35 + 0,246 ×37 = 35,453 
Модель состояния электрона в атоме:
При химических реакциях ядра атомов не изменяются, поэтому химические свойства элементов полностью определяются свойствами электронов, т.е. строением электронной оболочки атома. Основой современной теории строения атома являются законы и положения квантовой механики. Согласно квантовомеханическим представлениям, движущимся микрообъектам присуща двойственная природа, они являются частицами, но имеют волновой характер движения, т.е. обладают корпускулярными и волновыми свойствами. Движение электронов в атоме описывают с помощью орбиталей. Каждой атомной орбитали отвечает определенная форма и размер электронного облака.
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Состояние электрона в атоме характеризуется определенными значениями квантовых чисел.
1) Главное квантовое число (n) определяет энергию электрона и размеры электронного облака: чем больше значение квантового числа, тем больше энергия электрона и тем больше размеры имеет его электронное облако.
Каждый энергетический уровень характеризуется определенным значением n, равным номеру уровня.У атомов элементов первого периода – один энергетический уровень, второго периода – 2 уровня, третьего периода – 3 уровня. Уровень с номером n содержит n2 орбиталей. Максимальное число электронов определяется формулой:
N = 2n2, где
N – наибольшее число электронов на энергетическом уровне
n – номер уровня или главное квантовое число
Главное квантовое число для атомов известныхэлементов имеет значения:1; 2; 3; 4; 5; 6; 7 или К; L; M; N; O; P; Q
2) Орбитальное (побочное) квантовое число l характеризует форму электронного облака.
При данном главном квантовом числе n, орбитальное квантовое число может принимать любые целые значения от 0 до ( n-1).
· Так значению n =1 соответствует единственное значение орбитального квантового числа 1= 0. Это означает, что первый энергетический уровень состоит всего из одного s – подуровеня.
· Второй от ядра энергетический уровень расщепляется на два подуровня: s - и p-, т.к. значению n = 2 отвечает два значения орбитального квантового числа: n = 0 и l =1.
· Третий от ядра уровень расщепляется на три подуровня: (значению n =3 отвечает три значения l: l = 0, l =1, l =2).
· Четвертый энергетический уровень расщепляется на четыре подуровня:
s-, p-, d-, f (значению n =4 отвечает четыре значения l: l=0,l=1,l=2,l=3).
· Пятый, шестой и седьмой энергетические уровни также состоят их четырех подуровней s-, p-, d-, f.
Совокупность всех орбиталей, с одинаковыми значениями n и 1 называют подуровнями. Каждый подуровень характеризуется определенным набором двух квантовых чисел n и l. Такое состояние электрона, соответствующее определенным значениям n и l, записывается в виде сочетания цифрового обозначения n и буквенного l. Например: 4p (n = 4; l = 1)
3) Магитное квантовое число – определяет направление (ориентацию) орбиталей в пространстве и может принимать любые целочисленные значения от – l до + l, включая нулевое.
Так, значению l = 0 отвечает одно значение ml = 0, т.е. s – подуровень состоит из одной орбитали; значению l = 1 отвечает три значения магнитного квантового числа: ml = +1, ml = 0 и ml = -1, т.е. p-подуровень состоит из трех орбиталей и т.д.
Число орбиталей на подуровне равно 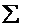 ml =2 × l +1
ml =2 × l +1
4)Спиновое квантовое число определяет направление вращения электрона вокруг своей оси.
Спиновое квантовое число, независимо от других квантовых чисел, может принимать только два значения: + 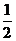 (условно обозначают) и -
(условно обозначают) и - 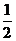 (условно обозначают¯) Распределение электронов в атоме по орбиталям называется электронной конфигурацией атома.
(условно обозначают¯) Распределение электронов в атоме по орбиталям называется электронной конфигурацией атома.
Оно определяется тремя принципами:
1.Принцип Паули. В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
На каждой орбитали может находится не более двух электронов.
Если на орбитали находится один электрон, то его называют неспаренным электроном. Если на орбитали два электрона, то это спаренные электроны.
2.Принципом наименьшей энергии, который определяет последовательность заполнения электронами орбиталей. При составлении электронной конфигурации атома или иона необходимо заполнять электронами свободные орбитали с наименьшей энергией.
В большинстве атомов энергия орбиталей увеличивается в ряду:
1s <2s< 2p< 3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p
3.Правило Хунда; При заполнении орбиталей, относящихся к одному подуровню, электроны располагаются таким образом, чтобы их суммарный спин был максимальным.
Структура электронной оболочки атома с расположенными по уровням и подуровням и орбиталям электронами называется электронной конфигурацией атома и записывается в виде электронной формулы.
При составлении электронной формулы:
· вначале цифрой указывают номер уровня (значение главного квантового числа n)
· затем буквами s, p, d, f – значение орбитального квантового числа
· у буквы вверху справа - число электронов на данном подуровне.
При графическом изображении электронной конфигурации орбитали обозначают квадратиками, а электроны на них стрелочками.
Электронные формулы атомов химических элементов составляют в следующем порядке:
3. сначала определяют общее количество электронов элемента – оно равно порядковому номеру элемента;
4. затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
5. уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии с правилом Гунда.При этом учитывают, что каждый s-подуровень максимально вмещает 2 электрона, p-подуровень- 6 (3 орбитали по 2 электрона), d – подуровень -10 (5 орбиталей по 2 электрона).
Электроны, находящиеся на внешнем энергетическом уровне, где они имеют наибольшую энергию, называют валентными, которые и определяют химические свойства элементов.
Графические электронные формулы:
Ячейка (клетка) обозначает орбиталь
Стрелка – электрон
Направление стрелки – направление спина
Свободная клетка – свободная орбиталь
| Элемент | Графическая электронная формула | Подробная электронная формула |
  
 6С 6С
|  s
↓
n = 2 px py pz
n = 1 s
↓
n = 2 px py pz
n = 1
|
1s22s22 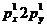
|

Химические элементы в зависимости от того, какой энергетический подуровень заполняется последним, различают четыре типа элементов:
1. s-элементы. Заполняется электронами s-подуровень внешнего уровня – первые два элемента каждого периода периодической системы Менделеева. (14 элементов).
2. р-элементы. Заполняется р-подуровень внешнего уровня – это последние 6 элементов каждого периода Исключение - первый и седьмой период. (30 элементов).
3. d-элементы. Заполняется d-подуровень второго снаружи уровня, а на внешнем уровне остается 1 или 2 электрона (у палладия – нуль). К ним относятся элементы вставных декад больших периодов, расположенные между s и р-элементами. Их называют - переходные элементы.(35 элементов.)
4. f-элементы. Заполняется f-подуровень третьего снаружи уровня, а на внешнем уровне остается 2 электрона – это лантаноиды и актиноиды. (28 элементов).
Периодический закон (Д.И. Менделеев, 1869 г):
Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов. Этот закон объясняется тем, что при увеличении заряда ядра увеличивается общее число электронов и периодически изменяется конфигурация валентных электронов. Что приводит к периодическому изменению свойств элементов: радиуса атома, энергии ионизации, электроотрицательности и др.
Периодическая система элементов – это графическое изображение периодического закона. Она состоит из 7 периодов (10рядов) и 8 групп.
Период - это горизонтальный ряд элементов, расположенных в порядке возрастания порядкового номера от первого s- элемента до шестого p - элемента (ns2np6). Каждый период (кроме первого) начинается щелочным металлом и заканчивается инертным газом, перед которым стоит активный неметалл. При этом номер периода совпадает со значением главного квантового числа внешнего энергетического уровня.
Группа - вертикальный ряд элементов в Периодической системе. Внутри групп выделяют главные и побочные. Главными называют подгруппы, состоящие только из - s и - p элементов. У элементов главных подгрупп число электронов на внешнем уровне совпадает с номером группы. Побочными называют подгруппы состоящие из элементов, у которых заполняется - d или - f подуровень. У элементов побочных подгрупп на внешнем уровне обычно находится два электрона (исключение составляют атомы Cu, Аg, Au,Cr, Nb, Mo, Ru, Rh - у которых на внешнем уровне один электрон, у Pd на внешнем уровне ноль электронов). Число электронов на предпоследнем (предвнешнем) уровне и число внешних электронов равно номеру группы.
Порядковый номер элемента – равен заряду ядра, количеству электронов и числу протонов.
Номер периода – числу энергетических уровней в электронной оболочке атома.
Номер группы –максимальной валентности и максимальной положительной
степени окисления.
Периодичность объясняется определенной повторяемостью в заполнении
электронных уровней. Чем больше атомный радиус, тем слабее удерживаются
внешние электроны.
Способность атомов удерживать валентные электроны характеризуется
величинами, называемыми: энергией ионизации, сродством к электрону и
электроотрицательностью.
Энергия ионизации – минимальная энергия, необходимая для отрыва наиболее слабо связанного электрона от атома (выражается в электрон-вольтах). При отрыве электрона образуется катион.
Сродство к электрону- энергия, которая выделяется при присоединении к
атому одного электрона (выражается в электрон-вольтах). При присоединении
электронов к атому образуется анион.
Электроотрицательность - способность атома в молекуле притягивать к
себе электроны.
X = I + E, где
X – электроотрицательность атома (элемента)
I – энергия ионизации атома
Е – сродство к электрону
При рассмотрении периодичности изменения свойств элементов принято
характеризовать изменение их металлических и неметаллических свойств.
Основным химическим свойством, отличающим металлы от неметаллов,
является способность неметаллов в химических реакциях принимать
электроны. Металлы проявляют только положительные степени окисления в
соединениях и никогда электроны не принимают. Металличность элемента
характеризуется способностью отдавать электроны, чем легче они это
делают, тем сильнее проявляют металлические свойства. Металлические и
неметаллические свойства характеризуются энергией взаимодействия внешних
валентных электронов с ядром атома и зависят от таких характеристик атома: 1.число электронов на внешней оболочке;
2. радиус атома;
3. заряд ядра атома.
Для описания свойств элемента по его положению в периодической системе необходимо рассматривать изменение этих характеристик в периодах и группах.
В периоде слева направо увеличивается число электронов на внешней оболочке атома, увеличивается заряд ядра и уменьшается радиус атома. Все это увеличивает притяжение валентных электронов к ядру и затрудняет их отрыв. Поэтому металлические свойства в периодах слева направо уменьшаются. В четных рядах больших периодов не происходит увеличение числа электронов на внешней оболочке и поэтому ослабление металлических свойств слева направо более постепенное за счет увеличения заряда ядра и уменьшения радиуса атома.
В группе металлические свойства сверху вниз усиливаются, т.к. при одинаковом числе валентных электронов их притяжение к ядру ослабевает за счет увеличения радиуса атома.
Изменение характера окислительных или восстановительных свойств элементов соответствует изменению их металлических или неметаллических свойств.
Свойства оксидов различных элементов принято определять в зависимости от кислотного, основного или амфотерного характера образуемых ими гидроксидов. Чем сильнее выражены неметаллические свойства элемента, тем сильнее проявляются кислотные свойства его гидроксида. Для одного и того же элемента с увеличением степени окисления кислотный характер его гидроксида увеличивается.
Контрольное задание №3.
Для приведенных в таблице элементов:
· изобразите электронную и электронно-графическую структуру атомов элементов.
· Укажите, к какому семейству относится каждый элемент
· Напишите набор квантовых чисел для валентных электронов
· с помощью электронной формулы определите положение элемента в периодической системе (период, группа, подгруппа) и предскажите главные химические свойства (металл или неметалл, степени окисления, формулы и характер оксидов)
| № | Элементы | № | Элементы | № | Элементы | № | Элементы |
| Na, P | Cr, Si | Al, Mg | P, Tc | ||||
| K, N | S, Fe | Sb, Cd | Zn, S | ||||
| Mn, B | As, Co | Bi, Ba | Cd, Br | ||||
| Te, Sc | Se, Ni | In, Ag | Sr, Se | ||||
| C, Mo | Pb, In | Hg, Cl | |||||
| S, Fe | Mn, B | Ga, Be | |||||
| As, Co | In, Ag | Sr, Se |