Количественный состав раствора как одна из главных характеристик раствора.
Количественный состав раствора выражается с помощью понятия концентрация, под которым понимается содержание растворенного вещества в единице массы или объема раствора. Выражают через молярную и моляльную концентрацию, молярные и массовые доли.
Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента (или нормальная концентрация), массовая концентрация (или титр).
1. Массовая доля (ω) - отношение массы соответствующего компонента в растворе к общей массе этого раствора. Выражается в единицах или процентах.
ω (х)= 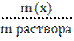
Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
2. Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора.
См= 
Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Сокращенно пишут М.
1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
0,001М – милимолярный раствор.
3. Нормальная концентрация (молярная концентрация эквивалента, СN) - количество моль- эквивалентов вещества, содержащегося в 1 л раствора.
СN= 
Единица измерения моль-экв/л, Сокращенно обозначается буквой N.
Химический эквивалент, закон эквивалентов.
Эквивалент вещества - такое количество его, которое взаимодействует с одним моль атомов водорода или вообще с одним эквивалентом любого другого вещества. Обозначается эквивалент Э (Х), выражается в молях.
Закон эквивалентов: Вещества взаимодействуют и получаются в массовых количествах прямо пропорционально их эквивалентам.

m1, m2- массы веществ,
Э1, Э2- эквиваленты веществ.
5. Эквивалентная масса вещества, еѐ связь с молярной массой, фактор эквивалентности. Правила расчѐта фактора эквивалентности для различных классов неорганических соединений.
Масса одного эквивалента вещества называется эквивалентной массой, обозначается Мэкв, выражается в г/моль-экв.
Эквивалент зависит от типа реакции.
Способы расчета Мэкв.
• 
• 
• 
Изменения эквивалента вещества (эквивалентной массы) в зависимости от реакций, в которых участвует вещество.
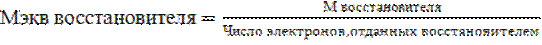
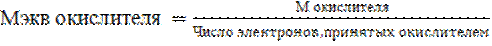
Объёмный анализ как раздел количественного анализа.
Титриметрический (обьемный) анализ — метод количественного анализа, основанный на измерении объёма раствора реактива с точно известной концентрации, расходуемого для реакции с определяемым веществом.
Титрование — процесс определения титра исследуемого вещества.

 - титр раствора в г/мл
- титр раствора в г/мл
8. Стандартные растворы, способы их приготовления. Понятия «первичный стандарт» и «вторичный стандарт». Типовые расчѐты по практическому приготовлению растворов.
Стандартные - растворы с известной концентрацией, которые служат для определения концентрации других растворов
Способы приготовления стандартных растворов:
1. Метод точной навески
2. Метод неточной или приблизительной навески
3. Метод разбавления
4. Фиксанальный метод
Первичный стандарт - стандартный раствор, приготовленный по точной навеске
Вторичный стандарт - стандартный раствор, характеристики которого установлены по первичному стандарту