Щелочность и кислотность почв
По формам проявления кислотных и щелочных свойств почв принято различать актуальную и потенциальную кислотность и щелочность.
Актуальная кислотность и щелочность характеризуются концентрацией ионов водорода и гидроксила в почвенном растворе.
Степень кислотности и щелочности почвенных растворов, вытяжек и суспензий оценивают величиной рН, количественно кислотность и щелочность определяют по содержанию титруемых, соответственно, щелочами (обычно NаOH) или кислотами (НСl) веществ, обладающих кислыми или щелочными свойствами.
На практике чаще измеряют рН водной вытяжки или водной суспензии, а не рН почвенных растворов кислотность почвенных растворов связана с присутствием в почвах свободных органических (главным образом, гумусовых) и неорганических (преимущественно, угольной) кислот и других органических и минеральных соединений, способных оказывать влияние на кислотно-основное равновесие В почвенных растворах. Среди таких органических компонентов почв следует назвать соединения, содержащие фенольные группы, а среди минеральных компонентов - катионы Al3+ и Fe3+, кислотные свойства которых соизмеримы с кислотными свойствами таких кислот, как угольная и уксусная.
Потенциальные кислотность и щелочность почв проявляются в результате различных воздействий на почву. В настоящее время понятие потенциальной кислотности почв разработано значительно более подробно, чем понятие потенциальной щелочности, сведений о которой недостаточно.
Потенциальную кислотность почв принято определять при воздействии на почву растворов хлорида калия (обычно 1 N. раствор КCl) - обменная кислотность, - или растворов гидролитически щелочной соли (обычно 1 N. раствор CH3COONa)-гидролитическая кислотность.
|
|
Величину обменной кислотности оценивают по величине рН солевой вытяжки. Для количественного определения кислотности солевую вытяжку титруют раствором щелочи.
В случае обработки почвы раствором КCl возможны следующие реакции обмена катионов почвенно-поглощающего комплекса:
| ППК-H+ + KCl = ППК-K+ + HCl | |
| ППК-Al3+ + 3KCl = ППК-K3+ + AlCl3 |
В дальнейшем, при титровании солевой вытяжки раствором NaOH в реакцию вступают HCl и AlCl3:
| HCl + NaOH = NaCl + H2O | |
| AlCl3 + 3NaOH = 3NaCl + Al(OH)3 |
Ионы Al3+, выделенные из почвенно - поглощающего комплекса в раствор, оказывают влияние на степень кислотности, поскольку в водных фазах образуются ионы Аl(ОН)2+ и Al(OH)2+.
Пpoцecc ионного обмена, протекающий при обработке почвы раствором CH3COONa, можно представить уравнением:
| ППК-H+ + CH3COONa = ППК-Na+ + CH3COOH |
Уксусная кислота, образующаяся в этом случае, как известно, значительно слабее, чем НCl, выделяющийся при обработке почв растворами KCl. Поэтому процесс обмена по реакции протекает более глубоко и величина гидролитической кислотности всегда выше, чем величина обменной кислотности. Значения рН водной вытяжки после обработки почвы 1 N. раствором CH3COONa обычно находятся в интервале 6,2-7,5 в отличие от рН 3,0-6,5, характерного для случая обработки почв раствором КСl. Интервал рН 6,2-7,5 соответствует области минимальной растворимости Al(OH)3, поэтому, хотя Al3+ и оказывает влияние на величину гидролитической кислотности и участвует в обмене катионов в водной вытяжке, полученной при обработке почв раствором CH3COONa, соединений алюминия практически нет.
|
|
Соединения азота в почве
Основное количество соединений азота сосредоточено в верхнем почвенном горизонте и представлено, главным образом, органическими соединениями. В среднем на долю азота приходится около 5 % от массы органического вещества почвы, что составляет обычно 0,02-0,4% от массы пахотного слоя почв. Помимо органических соединений (гумусовые вещества и растительные остатки), азот в почве присутствует в виде неорганических компонентов в почвенном воздухе, почвенном растворе и в обменном или фиксированном состоянии входит в состав твердой фазы почв.
Среди органических соединений азота от 20 до 50% составляют аминокислоты, обнаруживается присутствие амидов, аминосахаров и гетероциклических соединений. Около 50% органических соединений азота остаются неидентифицированными. Все органические соединения азота можно разделить на легко разлагаемую и стабильную фракции. На долю первой приходится обычно менее одной трети всего органического азота почвы.
Органические соединения азота, содержащиеся в почве, являются основным резервом для питания растений. В результате процессов химической и, преимущественно, биохимической трансформации этих соединений происходит образование доступных для растений веществ, протекает так называемый процесс мобилизации азота.
Соединения азота всегда содержатся в поступающих в почву растительных остатках и мобилизуются в процессе их разложения. Особенно интенсивно этот процесс протекает на ранних стадиях распада растительных остатков, когда соотношение массы углерода и азота в них ниже 20. В дальнейшем скорость поступления соединений азота определяется
|
|
При газовом обмене с атмосферным воздухом часть почвенного азота теряется.скоростью разложения органического вещества почвы.
В почвенном воздухе соединения азота представлены молекулярным азотом, аммиаком, гемиоксидом, оксидом и диоксидом азота.
Главными причинами образования газообразных соединении азота в почве является протекающие при участии микроорганизмов процeccы аммонификации, нитрификации и денитрификации.
Аммонификация - это процесс разложения органических веществ, протекающий с участием специфических аммонифицирующих микроорганизмов. В результате этого процесса в почвенном воздухе появляется газообразный аммиак, а в почвенном растворе - ионы аммония.
Неорганические соединения азота присутствуют в почве в виде NH4+ и NО3- , лишь в некоторых щелочных почвах могут встречаться небольшие количества ионов NО2-.
Нитрофикация
Окисление аммиака микроорганизмами протекает в два этапа. На первом этапе под воздействием бактерий Nitromonas происходит окисление ионов NH4+ до ионов NО2-. Образующиеся на этой стадии соли азотистой кислоты подвергаются дальнейшему окислению, которое протекает с участием бактерий Nitrobacter. При этом ионы NО2- переходят в NО3-.
В процессе нитрификации в почву поступают ионы водорода:
NH4+ + 2О2 = NО3- + Н2О + 2Н+
Поэтому процессы нитрификации сопровождаются закислением почв, и при длительном применении, аммонийных удобрений необходимо предусматривать компенсирующее известкование почв.
Если аэрация почв затруднена нитрификация может прекратиться, и в почве начнутся процессы денитрификации.
Денитрификацкя - процесс восстановления, в результате которого происходит образование газообразных соединений азота, выделяющихся в атмосферу. Различают два пути денитрификации: косвенный, или химический, и прямой, или биологический.
Косвенный процесс денитрификации связан с протеканием химических реакций:
| R-NH2 + HNO2 = ROH + N2 + H2O | |
| (NH2)2CO + 2HNO2 = 2N2 + CO2 + 3H2O | |
| 2HNO3 = NO + NO2 + 2H2O + O2 | |
| 3HNO2 = 2NO + HNO3 + H2O |
Разложение азотной и азотистой кислот следует отнести к основным процессам косвенной денитрификации в кислых почвах при рН<5,5. Для таких почв отмечалось заметное увеличение содержания диоксида азота в почвенном воздухе, что указывает на преимущественное протекание процесса разложения ионов NО3-. Небиологическому восстановлению нитритов могут способствовать Cu2+, Fe2+, Mn2+ и увеличение содержания органических компонентов с фенольными группами. В некоторых предварительно стерилизованных почвах в течение 10 дней содержание нитритного азота уменьшалось в результате процессов косвенной денитрификации в 3 раза.
Однако, как отмечается многими исследователями, косвенная денитрификация играет значительно меньшую роль в процессах восстановления соединений азота, чем биохимическая денитрификация.
Различают два типа процессов биохимической денитрификации: специфическую, или диссимиляторную, и неспецифическую денитрификации. В процессе диссимиляторной денитрификации происходит восстановление нитратов до молекулярного азота в результате переноса электронов с субстрата (донора электронов) на нитраты, при этом высвобождается необходимая для микроорганизмов энергия. Неспецифическая денитрификация не выполняет энергетических функций. В этом процессе нитраты восстанавливаются преимущественно до нитритов.
Неспецифическую денитрификацию часто рассматривают как первую стадию процесса денитрификации, при которой нитраты восстанавливаются до нитритов. Дальнейшее восстановление происходит в результате диссимиляторной денитрификации и протекает при участии микроорганизмов из родов Pseudomonos, Achromobacter, Micrococcus, Bacillus, Thiobacillus. Эти бактерии в большинстве являются факультативными анаэробами и используют нитраты как источник энергии в отсутствие кислорода.
Подавляющее большинство денитрифицирующих бактерий, как уже отмечалось выше, относится к факультативным анаэробам, которые при большой концентрации кислорода могут перейти на обычное дыхание. Поэтому процесс денитрификации протекает и в аэробных, и в анаэробных условиях. Однако наиболее интенсивно этот процесс протекает в плохо дренированных почвах при величине рН раствора, близкой к нейтральной, температуре порядка 25°С и окислительно-восстановительном потенциале почвенного раствора менее 0,35 В.
Необходимо отметить, что в npoцecce денитрификации часто происходит образование заметных количеств гемиоксида азота. Ежегодная эмиссия N2O из почв, по данным Д.С. Орлова, может достигать 20-50 г/га. Как известно, инертный в тропосфере, гемиоксид азота, достигая стратосферы, разлагается с образованием оксида азота, нарушающего нулевой цикл озона. Поэтому увеличение количества образующегося в почве гемиоксида азота, которое связано с ростом использования азотных удобрений, может оказать влияние на озоновый слой планеты.
Суммарно процесс трансформации неорганических соединений азота в почве можно представить схемой:
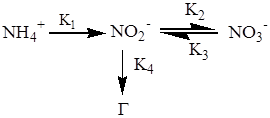
|
где K1,K2,K3,K4 - константы скоростей соответствующих реакций нитрификации и денитрификации, Г - сумма газов N2O, NO, NO2, N2. Скорости соответствующих реакций зависят от температуры почв, рН, степени аэрациии, следовательно, окислительно -восстановительного потенциала почвенного раствора, содержания влаги, органических веществ и ингибиторов. Реакции нитрификации относятся к реакциям первого порядка, а реакции денитрификации имеют нулевой порядок, поэтому можно записать:•
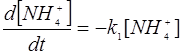
| (3.25) | |
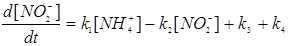
| ((3.26) | |
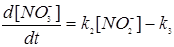
| (3.27) | |
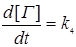
| (3.28) | |
Для средних условий почв соответствующие константы скоростей реакций равны:K1= 0,02 ч-1, К2= 0,04 ч-1, К3= 0,015 мг кг-1(N)*ч-1 К4= 0,01 мг кг-1(N)*ч-1. Величина константы скорости процесса окисления ионов NO2 в нитрат - ионы K2 - 2 раза превосходит константу скорости образования нитрит - ионов (К1), поэтому нитриты, как уже отмечалось, практически не накапливаются в почве. Значение констант К3 и К4 в значительной степени зависят от окислительно - восстановительных условий и присутствия ингибиторов в почве.
Природными источниками поступления соединений азота в почву являются соединения азота, присутствующие в атмосфере и поступающие с атмосферными осадками, азот атмосферы, фиксируемый бактериями, и азот, содержащийся в остатках живых организмов. К этим источникам все в больших количествах добавляются антропогенные поступления.
Органические остатки живых организмов подвергаются гумификации и аммонификации. Ионы NH4+ частично усваиваются растениями, частично участвуют в процессах гумификации или связываются почвенно-поглощающим комплексом. Часть ионов вымывается с инфильтрационной влагой или подвергается процессу нитрификации. Нитрат-ион активно поглощается растениями, частично подвергается денитрификации, замыкая тем самым биохимический цикл азота, а частично переходит в подземные воды, что во многих случаях приводит ких загрязнению.
Ежегодный баланс по соединениям азота, который долгие годы существовал в природе, в настоящее время нарушен, в следствие деятельности человека (слайд 16). Проблема стабилизации глобального цикла азота является одной из важнейших глобальных экологических проблем стоящих перед человечеством.