«Термодинамика химических процессов»
Вариант №
| Выполнил: Фамилия Имя студента | Проверил: ФИО преподавателя-рецензента | ||||||||||
| Факультет мехатроники и автоматизации |
| ||||||||||
| Группа |
Новосибирск, 2017
Задание. Дано уравнение реакции (запишите реакцию для вашего варианта).
1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин 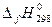 и
и  .
.
2. Вычислите изменение энтальпии реакции 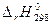 и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции 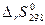 . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак
. Вычислив изменение энтропии реакции в стандартных условиях, объясните знак 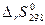 .
.
4. Вычислите энергию Гиббса прямой реакции в стандартных условиях 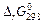 и установите возможность самопроизвольного протекания реакции.
и установите возможность самопроизвольного протекания реакции.
5. Определите температуру, при которой реакция находится в равновесии (Т р).
6. Рассчитайте 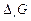 при Т 1 = Т р – 100 и при Т 2 = Т р + 100.
при Т 1 = Т р – 100 и при Т 2 = Т р + 100.
7. Постройте график зависимости 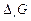 от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
8. Вычислите значения константы равновесия K равн при температурах Т 1 и Т 2. Cделайте вывод о влиянии температуры на величину K равн и на смещение химического равновесия.
Расчеты и пояснения
1. Записываем стандартные энтальпии образования и стандартные энтропии для реагентов и продуктов реакции, используя справочные данные
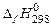 , , 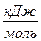
| ||||
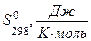
|
2. Вычисляем изменение энтальпии при протекании прямой реакции в стандартных условиях, используя …… (укажите, каким правилом пользуетесь, приведите математическую формулу для расчета, укажите единицы измерения)
Термохимическое уравнение реакции будет иметь вид:
Так как 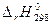 ..., то реакция является.... (экзо- или эндотермической).
..., то реакция является.... (экзо- или эндотермической).
3. Вычисляем изменение энтропии реакции 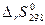 в стандартных условиях, используя …… (укажите, каким правилом пользуетесь, приведите математическую формулу для расчета, укажите единицы измерения):
в стандартных условиях, используя …… (укажите, каким правилом пользуетесь, приведите математическую формулу для расчета, укажите единицы измерения):
Объясните знак 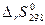 , не прибегая к расчетам.
, не прибегая к расчетам.
4. Вычисляем энергию Гиббса прямой реакции в стандартных условиях 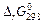 , используя …… (приведите математическую формулу для расчета, укажите единицы измерения)
, используя …… (приведите математическую формулу для расчета, укажите единицы измерения)
и объясняете направление самопроизвольного протекания реакции.
5. Рассчитываем температуру, при которой реакция будет находиться в равновесии. Реакция будет находиться в равновесии при 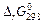 = 0, тогда
= 0, тогда
 К
К
6. Рассчитываем 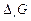 при Т 1 = Т р – 100 и при Т 2 = Т р + 100:
при Т 1 = Т р – 100 и при Т 2 = Т р + 100:
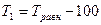 =
=
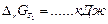
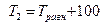 =
=
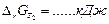
7. Строим график зависимости 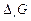 от
от 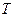 и определяем область температур самопроизвольного протекания реакции (либо заштриховать область на графике, либо объяснить по тексту).
и определяем область температур самопроизвольного протекания реакции (либо заштриховать область на графике, либо объяснить по тексту).
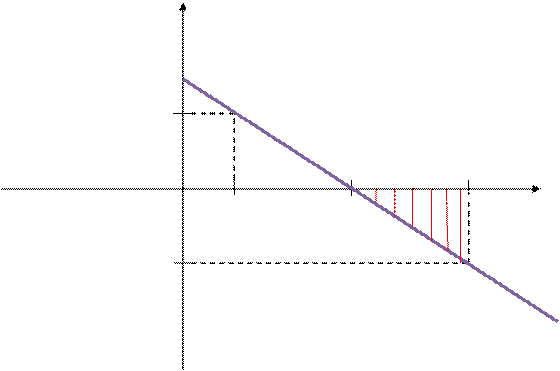
График зависимости 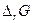 от температуры
от температуры
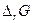 (
( )
)
Тр –100 Тр Тр + 100 Т, К
8. Вычисляем значения константы равновесия для температур Т 1 и Т 2:

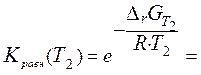
В заключении сделайте вывод о влиянии температуры на величину константы равновесия и на смещение равновесия.
Например, при повышении температуры константа равновесия эндотермической реакции ….(принимает значения больше/меньше единицы), следовательно, самопроизвольному процессу протекания реакции в прямом направлении будет способствовать (увеличение или уменьшение) температуры.