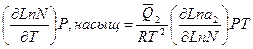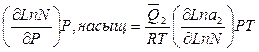Одной из важнейших стадий гидротермального процесса является растворение твердых веществ в определенном растворителе. Рассмотрим термодинамические условия, при которых возможен процесс растворения твердого вещества. Известно, что
∆G=∆H-T∆S (11.1.3.1)
|
|
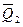 где N - растворимость твердого вещества; a 2— активность растворенного вещества; - теплота растворения 1 моля вещества в насыщенном растворе; R— газовая постоянная.
где N - растворимость твердого вещества; a 2— активность растворенного вещества; - теплота растворения 1 моля вещества в насыщенном растворе; R— газовая постоянная.
 Растворение твердого вещества можно представить как совокупность двух процессов; плавления твердого вещества и смешивание двух жидкостей. В случае идеальной растворимости твердого вещества теплота второго процесса равна О, и тогда равна теплоте плавления твердого вещества λ пл, и не зависит от выбора растворителя, а ¶Ln a 2/¶LnN=1.
Растворение твердого вещества можно представить как совокупность двух процессов; плавления твердого вещества и смешивание двух жидкостей. В случае идеальной растворимости твердого вещества теплота второго процесса равна О, и тогда равна теплоте плавления твердого вещества λ пл, и не зависит от выбора растворителя, а ¶Ln a 2/¶LnN=1.
Так как правая часть уравнения (11.1.3.2) больше нуля, то ¶Ln a 2/¶T>0 т.е. с ростом температуры идеальная растворимость твердых тел в их идеальном растворе увеличивается.
|
(11.1.3.3)
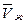 где порциапьный мольный объем растворенного вешества в растворе; V0ТВ - мольный объем этого вещества в твердой фазе. В случае идеального раствора ¶Ln a 2=¶LnN и ¶Ln a 2/¶LnN = 1
где порциапьный мольный объем растворенного вешества в растворе; V0ТВ - мольный объем этого вещества в твердой фазе. В случае идеального раствора ¶Ln a 2=¶LnN и ¶Ln a 2/¶LnN = 1
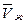 Таким образом, в случае идеальных растворов твердых тел в исследуемых средах растворимость с возрастанием давления будет падать, если мольный, объем растворяемого вещества увеличивается при его плавлении. Если же V0ТВ >,то растворимость должна увеличиваться при повышении давления.
Таким образом, в случае идеальных растворов твердых тел в исследуемых средах растворимость с возрастанием давления будет падать, если мольный, объем растворяемого вещества увеличивается при его плавлении. Если же V0ТВ >,то растворимость должна увеличиваться при повышении давления.
Достоинство гидрогермального метода состоит в том, что он позволяет при относительно высоких температурах получать кристаллы различных модификаций в области их устойчивости, регулировать рН и окислительно-восстановительные условия среды, стабильность тех или иных элементов в нужной валентности, изменять с помощью растворителей вязкость и плотность раствора с целью повышения подвижности элементов, склонных к процессу стеклообразования. Указанное обстоятельство позволяет получать монокристаллы с различными модификациями в области их стабильности, например, Sb2O3, соединения, в которых один и тот же элемент находится в разновалентном состоянии, а также те соединения, которые имеют склонность к стеклообразованию, например, силикаты и германаты различных элементов.
Выявление физико-химических закономерностей, управляющих течением процесса гидротермальной кристаллизации при повышенных давлении и температуре - основная задача теории и практики гидро-термального метода. При получении конкретных соединений в гидротермальных условиях необходимо ответить на вопросы.
1. Может ли быть принципиально реализован данный процесс кристаллизации и если да, то при каких условиях?
2. Каковы факторы, определяющие скорость и механизм кристаллизации, и как они могут оптимально осуществляться на практике?
Первый вопрос разрешается с помощью аппарата термодинамики равновесных процессов. При решении этого вопроса необходимо знать зависимости термодинамических функций и коэффициента активностей реагирующих веществ от температуры и давления, чтобы перейти от их стандартных значений к заданным конкретным условиям. По найденным величинам, например, изменениям свободной энергии или химического потенциала кристаллизуемого вещества, можно сделать вывод о возможности протекания процесса. Хотя в настоящее время общие принципы подобных термодинамических расчетов хорошо известны, необходимых для расчета значений термодинамических констант пока очень мало, что и затрудняет априорную термодинамическую оценку гидротермальной кристаллизации.
Термодинамическая оценка многих водных систем была детально обсуждена Пурбэ и наглядно воспроизведена им в виде диаграмм Еh - pН - окислительно-восстановительный потенциал. Так как процесс кристаллизации в гидротермальных системах протекает в водных растворах, т.е. в условиях, в которых условия меняются от сильно окислительных до сильно восстановительных, то применение диаграмм Eh- pH позволяет в принципе определить пределы физико-химических условий образования конкретного соединения. Применяя данные, полученные при помощи Еh- pH диаграмм, возможно заранее подобрать необходимые для кристаллизации растворители и ограничить по величине Еh- pH область образования того или иного соединения.
Необходимо отметить, что термодинамическое рассмотрение гидротермальной системы позволяет только сделать заключение о возможности существования данного процесса кристаллизации, но не может дать сведений о кинетике протекания процесса, т.е. говоря иными словами, термодинамика не может однозначно ответить на вопрос: пойдет ли реакция кристаллизации вдали от равновесия или прекратится где-либо, не доходя до него? Так как обычно гидротермальные процессы проводятся в условиях термодинамически благоприятных, т.е. в этих процессах имеет место значительное снижение свободной энергии-кристаллизации, то они лимитируются в основном лишь кинетическими факторами. Если величины изменения свободной энергии различных кристаллизующихся соединений заметно отличаются друг от друга, то направление процесса, иначе говоря, последовательность образования монокристаллических фаз в обоих случаях определяется константой скорости реакции, т.е. кинетическим фактором. Последнее подчеркивает необходимость кинетической оценки гидротермального процесса, который протекает в гетерогенных системах, включающих поверхность разделов шихта - раствор и кристалл - раствор. Как известно, процесс гидротермальной кристаллизации в идеальном случае протекает по следующим этапам: 1) растворение исходные компонентов шихты; 2) синтез и перенос растворенных реагентов из основной массы раствора в зону кристаллизации; 3) достижение состояния пересыщения; 4) образование зародышей; 5) рост кристаллов.
Большое значение для успешного протекания гидротермальной кристаллизации имеет первая стадия - стадия растворения исходных компонентов. В простейшем случае процесс растворения состоит из 3-х стадий: диффузии растворителя к поверхности шихты, гетерогенной реакции образования растворимого соединения из исходных компонентов с участием или без участия растворителя, массопереноса растворенного вещества от межфазной границы в массу раствора. Скорость всего процесса лимитируется самой медленной стадией.
Обычно, если К0 < Кр (где К0 - коэффициент диффузии Кр - константа скорости химической реакции), то процесс растворения протекает в диффузионной области, а когда знак соотношения коэффициентов противоположный, то в кинетической области. Когда процесс растворения сопровождается положительным тепловым эффектом, т.е. ∆Н<0, константа реакции увеличивается с температурой. Как правило, для кинетической области характерно сильное увеличение скорости реакции с температурой, в то время как для диффузионной области этого не отмечается. Обычно, чем больше величина температурного перепада ∆Т, тем интенсивнее происходит движение раствора между зонами растворения и распада, т.е. иначе говоря, чем больше пересыщение, тем больше скорость роста кристаллов. Вместе с тем следует отметить, что при данном перепаде температур перепад давлений ∆Р, а с ним и интенсивность движения раствора, увеличивается по мере роста коэффициента заполнения автоклава. К тому же с увеличением коэффициента заполнения автоклава увеличивается растворимость, а стало быть, и концентрация раствора. Поэтому можно сделать заключение о том, что с увеличением коэффициента заполнения скорость роста кристаллов возрастает. Коэффициент заполнения автоклава обычно изменяют в пределах значений 0,6-0,9. На практике лимитирующую стадию процесса растворения определяют из величины энергии активации процесса. В изотермических условиях (∆Т =0, где ∆Т - температурный перепад) процесс кристаллизации вещества в гидротермальных условиях осуществляется за счет концентрационной диффузии, а при (∆Т > 0) - за счет конвекции, обусловленной разностью плотностей раствора в "горячей" и "холодной"' зонах реактора. Скорость переноса конвекцией во много раз больше скорости собственной диффузии, т.е. конвекция, как правило, повышает скорость, реакции растворения, лимитируемой диффузионными процессами. Если реакция растворения какого-либо вещества или системы веществ протекает в кинетической области, то процесс будет ускоряться при условии наличия конвекции. Физико-химические процессы растворения в зависимости от механизма протекающих реакций подразделяются на два типа: а) процессы, проходящие без изменения валентности ионов растворителя и растворенного вещества, б) процессы, протекающие с изменением валентности ионов растворителя и растворенного вещества. При гидротермальной кристаллизации правильно подобранная скорость растворения различных компонентов шихты и переноса имеет большое значение для успешной кристаллизации конкретных соединений. Нужная скорость растворения шихты на практике достигается подбором простых и сложных растворителей, а также подбором определенных композиций шихты, обладающих разной степенью активности. После растворения шихты и ее переноса при достижении в "холодной" зоне реактора локально высокой степени пересыщения начинается рост кристаллов.