Утверждено
на заседании кафедры
Протокол № ___ от ___________ 2016 года
Заведующая кафедрой_______________
_____________Иванова Н.С.
Методические рекомендации
по проведению самостоятельной работы студентов
модуль № 1 «Основные типы химических реакций и процессов в функционировании живых систем»
учебной дисциплины Химия
для специальности 31.05.01«Лечебное дело»
курс Ӏ семестр Ӏ
Составитель Усова М.Г.,
ст. преподаватель
Рецензент Задорожная А.Н.,
к.х.н., доцент
Владивосток, 2016
1.Тема СРС: Основные типы химических реакций и процессов в функционировании живых систем.
2.Мотивация изучения темы: приготовление растворов заданной концентрации, установление концентрации растворов, знание химической природы буферных систем и механизма их действия, исследование процессов комплексообразования, окислительно-восстановительных процессов позволяет раскрыть возможности для решения теоретических и практических проблем в
- биохимии: исследование свойств белков, ферментов, гормонов, БАВ; изучение обменных процессов организма;
- патофизиологии, клинической патофизиологии: изучение кислотно - основного состояния организма в норме и при патологиях;
- микробиологии, вирусологии: приготовление питательных сред при культивировании бактерий и проведение иммунологических исследований;
- клинической фармакологии: выбор условий применения лекарственных препаратов;
- гигиене: контроль степени загрязнения объектов окружающей среды, пищевых продуктов и др.
3.Цели самостоятельной работы студентов:
- изучить способы выражения концентрации растворов, основы метода объемного анализа для установления концентрации растворов;
- изучить химическую природу буферных растворов, механизм их действия;
- изучить строение комплексных соединений, научиться прогнозировать направление и результат процессов, протекающих с участием комплексных соединений;
-выработать умение, на основе термодинамических расчетов, прогнозировать направление и оптимальные условия окислительно-восстановительных процессов;
3.1.Общая цель: изучение темы направлено на формирование компетенции по ФГОС специальности ОПК - 7.
Конкретные цели и задачи.
После изучения темы студент должен:
«знать» - способы выражения концентрации растворов, закон эквивалентов, расчётные формулы для концентрации растворов и массы определяемого вещества, кислотно-основное равновесие в организме, химическую природу буферных растворов и механизм их действия, буферные системы крови, строение комплексных соединений, изолированное и совмещенное лигандообменное равновесие; константу нестойкости (Кн); основные положения теории окислительно-восстановительных процессов, сопряженные окислительно-восстановительные пары, правило, определяющее направление ОВР, связь электродвижущей силы с константой равновесия; типы и особенности ОВР, протекающих в организме;
«уметь» - решать типовые и ситуационные задачи, опираясь на теоретические положения. Ориентироваться в справочных данных. Делать выводы по результатам расчёта.
«владеть» - навыками решения задач, с использованием различных способов выражения концентрации, закона эквивалентов, лежащего в основе титриметрического анализа, приготовления буферных растворов, определения буферной емкости и зоны буферного действия, навыками составления уравнений окислительно-восстановительных реакций, прогнозирования возможности осуществления и направление протекания окислительно-восстановительных процессов.
4. Контрольные вопросы.
1. Способы выражения концентрации растворов. Способы приготовления растворов.
2. Сущность методов объемного анализа: понятие титранта, точки эквивалентности, способы приготовления рабочих растворов; механизм действия кислотно-основных индикаторов). Метод нейтрализации.
3. Буферные растворы: механизм действия, анализ уравнения Гендерсона-Хассельбаха. Буферная емкость.
4. Строение и свойства КС: гибридизация орбиталей комплексообразователя, устойчивость комплексных соединений в растворе, константа нестойкости комплексного иона. Лигандообменные равновесия.
5. Окислительно-восстановительные равновесия и процессы.
Задания для самостоятельной работы студентов.
| Вопросы для самостоятельного изучения | Виды и содержание самостоятельной работы |
| 1. Способы выражения концентрации растворов. Способы приготовления растворов | Для закрепления и систематизации знаний: - работа с обязательной и дополнительной литературой, интернет – ресурсами. Для формирования умений: Задача №1. Рассчитайте массовую долю и молярной концентрацией эквивалента серной кислоты в растворе с молярной концентрацией, равной 0,178 моль/л, (ρ= 1,025 г/мл). Задача №2. Рассчитать объём раствора NaOH с ω = 8%, ρ = 1,04 г/мл, необходимый для приготовления 100 мл раствора с С (1/1NaOH) = 0,1 моль/л методом разбавления. |
| 2. Сущность методов объемного анализа. Метод нейтрализации. | Для закрепления и систематизации знаний: - работа с обязательной и дополнительной литературой, интернет – ресурсами; Тест № 1 Индикатор, используемый при титровании раствора сильной кислоты раствором сильного основания: 1) мурексид; 2) фенолфталеин; 3) ализариновый красный T. Тест № 2 Объем (см3) 0,8 моль/л раствора KOH, необходимый для нейтрализации 24 см3 0,2 моль/л раствора HCl: 1) 3; 2) 6; 3) 12; Для формирования умений: Задача № 1 На титрование 15,0 мл раствора карбоната натрия в присутствии метилоранжа было затрачено 10,0 мл раствора хлороводородной кислоты С(НС1) = 0,075 моль/л. Вычислите молярную концентрацию эквивалента раствора карбоната натрия и массу карбоната натрия в исследуемом растворе. |
| 3. Буферные растворы: механизм действия, анализ уравнения Гендерсона-Хассельбаха. Буферная емкость. | Для закрепления и систематизации знаний: - работа с конспектом лекции № 1; - работа с обязательной и дополнительной литературой, интернет – ресурсами; Тест №1 При каких условиях рН буферной системы равна рКа а) когда соотношение объемов кислоты и её соли равно 0,5 б) когда равны концентрации кислоты и её соли при одинаковых объемах в) когда концентрация кислоты больше концентрации соли в 2 раза Тест № 2 Величину рН раствора необходимо поддерживать ≈ 6,9. Из буферных систем для этого можно использовать а) ацетатную (рКа = 4,76) б) фосфатную (рКа = 7,21) в) аммонийную (рКа = 9,24) Тест № 3 Для приготовления первого буферного раствора взяли 10 мл раствора с С(СН3СООН) = 0,1 моль/л и 20 мл раствора с С (СН3СООNa) = 0,05 моль/л. Для приготовления второго буферного раствора взяли 3 мл кислоты той же концентрации и 10 мл соли той же концентрации. Буферная ёмкость выше а) для первого буферного раствора б) для второго буферного раствора в) обоих растворов одинакова Для формирования умений: Задача №1 Рассчитайте молярное соотношение компонентов буферной смеси, содержащей аммиак и хлорид аммония, и имеющей рН 9,8. Задача № 2 Буферная емкость раствора по основанию равна 45 ммоль/л. Вычислите, какой объем раствора гидроксида натрия с молярной концентрацией 0,1 моль/л можно добавить к 250 мл этого раствора, чтобы сместить рН не более чем на 0,3 единицы? Задача №3 К раствору, содержащему ацетат натрия массой 16,4 г, добавили 50 мл соляной кислоты с концентрацией хлороводорода 1 моль/л. Объем полученного раствора довели дистиллированной водой до 1 л. Вычислите рН конечного раствора. |
| 4. Строение и свойства КС. | Для закрепления и систематизации знаний: - работа с конспектом лекции № 2; - работа с обязательной и дополнительной литературой; Тест №1 Геометрическая конфигурация молекул с sp3d2 гибридизацией комплексообразователя является а) линейная б) октаэдрическая в) квадратная Тест №2 В комплексном ионе [Zn(NH3)4]2+ заряд комплексообразователя а) +1 б) 0 в) +2 Тест №3 Связь во внутренней сфере комплекса а) ковалентная обменная б) ковалентная донорно-акцепторная в) ионная Тест №4 Формула соединения пентааминхлорокобальт (III) сульфат а) Na3[Co(NO2)6] б) [CoCl(NН3)5]2SO4 в) [CoCl(NН3)5]SO4 Тест №5 При одинаковых условиях лиганд ЭДТА (трилон Б) полнее связывает а) Mg2+, так как Кн(MgT2–) = 7,6∙10–10 б) Са2+, так как Кн(СаТ2–) = 2,6∙10–11 в) оба комплекса непрочные и легко разрушаются Тест №6 Действие препарата «Унитиол», используемого для выведения Hg2+ из организма, основано на а) образовании менее прочного комплекса, чем комплекс Hg2+ с биолигандом б) образовании более прочного комплекса, чем комплекс Hg2+ с биолигандом в) выпадении Hg2+ в осадок Для формирования умений: Задача № 1 Вычислите константу для равновесия для процесса [Mg Cytr]-+Cu2+↔[Cu Cytr]-+ Mg 2+ В каком направлении они протекают при равных концентрациях реагентов? Кн(Mg Cytr-)=1,1·10-4, Кн (CuCytr-)=1,3·10-6. Задача №2 Вычислите константы равновесия взаимодействия твердого хлорида серебра с растворами: а) цианида калия; б) тиоционата калия. Сделайте заключение о возможности протекания процессов в стандартном состоянии и при условии избытка лигандов. Ks(AgCl)=1,78×10–10, Kн([Ag(CN)2]-)=1,4×10–20 Kн[Ag(SCN)2]–=5,9×10–9. |
| 5. Окислительно-восстановительные равновесия и процессы. | Для закрепления и систематизации знаний:
- работа с конспектом лекции № 4;
- работа с обязательной и дополнительной литературой, интернет – ресурсами.
Тест №1
Стандартные потенциалы двух сопряжённых окислительно-восстановительных пар: Cr2O72– / 2Cr3+ (φº=1,36В) и Fe3+ / Fe2+ (φº=0,77В). Направление окислительно-восстановительной реакции
а) Cr2O72– + Fe2+ → 2Cr3+ +Fe3+
б) 2Cr3+ +Fe3+ → Cr2O72– + Fe2+
в) Cr2O72– + Fe3+ → 2Cr3+ +Fe2+
Тест №2
В реакции
MnO4– + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O сопряжённая окислительно-восстановительная пара, выполняющая роль окислителя
а) Mn2+ / MnO4–
б) MnO4– / Mn2+
в) Fe3+ / Fe2+
Тест №3
NO3– ионы не окисляют Fe(II) в растворе с рН=7, но окисляют в растворе с рН=1. Причина этого – соотношение потенциалов
а) 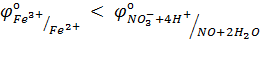 б)
б) 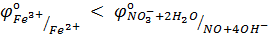 в)
в) 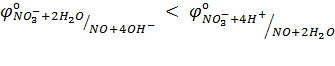 Для формирования умений:
Задача № 1
Известно, что соединения мышьяка проявляют сильные токсические свойства. При изучении свойств соединений мышьяка были обнаружены высокие восстановительные свойства арсенитов в щелочной среде. Составьте ионо-электронную схему и расставьте коэффициенты в уравнении реакции:
K3AsO3 + I2 + КОН " KI + K3AsO4 +
Задача №2
Для идентификации йодидов ГФХ рекомендует использовать раствор нитрита натрия. Составьте ионо-электронную схему и расставьте коэффициенты в уравнении реакции между йодидом калия и нитритом натрия, протекающей в сернокислой среде
Задача №3
Соотношение концентраций НАД+/ НАД-Н в цитоплазме клеток печени сытых крыс составляет 725, при голодании оно снижается до 208. Вычислите для каждой из систем величину редокс-потенциала и сравните их окислительную способность. Т=298 К, рН=7.
Для формирования умений:
Задача № 1
Известно, что соединения мышьяка проявляют сильные токсические свойства. При изучении свойств соединений мышьяка были обнаружены высокие восстановительные свойства арсенитов в щелочной среде. Составьте ионо-электронную схему и расставьте коэффициенты в уравнении реакции:
K3AsO3 + I2 + КОН " KI + K3AsO4 +
Задача №2
Для идентификации йодидов ГФХ рекомендует использовать раствор нитрита натрия. Составьте ионо-электронную схему и расставьте коэффициенты в уравнении реакции между йодидом калия и нитритом натрия, протекающей в сернокислой среде
Задача №3
Соотношение концентраций НАД+/ НАД-Н в цитоплазме клеток печени сытых крыс составляет 725, при голодании оно снижается до 208. Вычислите для каждой из систем величину редокс-потенциала и сравните их окислительную способность. Т=298 К, рН=7.
|