Определить какое количество жителей снабжается питьевой водой, при норме расхода хлора 0,0005 г/л и суточном потреблении хлора на обеззараживание воды 50 кг/сут., расход воды на 1 человека составляет 280 л.
Решение:
Общее потребление воды в сутки можно рассчитать, умножив суточное потребление хлора на норму расхода на 1 литр:
50 000 г: 0,0005 г/л =108 л
Разделив общее потребление воды на объем воды приходящийся на одного человека получим число жителей в городе.
100 000 000л: 280л = 357 тысяч жителей
№ 5.
Фармацевтическое предприятие, находящееся в Московской области (А = 140), занимается производством пенициллина. Какова должна быть величина ПДВ из вентиляционной трубы (высотой 3 м и диаметром 0,25 м) производственного цеха, если объемный расход выброса составляет 3 м3/с (коэффициенты: F = 1; m =1; n = 1,6; η = 1)? ПДК пенициллина = 0,0025мг/м3
Решение:
поскольку не указана температура выброса – следовательно, рассчитывать будем как «холодный» выброс:
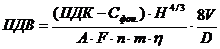 , где
, где
Cфон. – фоновая концентрация загрязняющего вещества в атмосфере, Н – высота источника выброса над уровнем земли (м), V – расход газовоздушной смеси (м3/с), A – коэффициент, зависящий от температурной стратификации атмосферы (зависит от географического положения местности), F – безразмерный коэффициент, учитывающий скорость оседания вредных веществ в атмосферном воздухе, m и n – коэффициенты, учитывающие условия выхода газовоздушной смеси из устья источника выброса, η – безразмерный коэффициент, учитывающий влияние рельефа местности.

Ответ: 0,0046 г/с.
№6.
Определите суточный расход хлора на хлорирование воды в городе с миллионом жителей, если принять, что расход воды на человека 350 л, а норма расхода хлора 2⋅10–4 г/л.
Решение:
На 1 человека – 350 л воды
На 1 000 000 человек – 350 000 000 л воды
35*107л * 2 * 10-4 г/л = 70 000 г или 70 кг
Ответ: 70 кг.
№ 7.
Какова максимальная суммарная масса каждого из перечисленных металлов, которые могут ежедневно проходить через городскую сеть водоснабжения мощностью 1⋅107 л в день, если концентрация этих металлов не должна превышать: цинка - 5 мг/л, кадмия - 0,01 мг/л, марганца - 0,05 мг/л, меди - 1 мг/л. Ответ: 50; 0,1; 0,5; 10 кг.
Решение:
Цинк: m(Zn) = 5мг/л*107л = 5*107 мг или 50 кг
Кадмий: m(Cd) = 0,01мг/л*107л = 1*105мг или 0,1 кг
Марганец: m(Mn) = 0,05мг/л*107л = 5*105мг или 0,5 кг
Медь: m(Cu) = 1мг/л*107л = 1*107мг или 10 кг
№8
В реку с расходом воды Q = 250м3/с сбрасываются сточные воды предприятия, содержащие фенол, которого нет в исходной воде, забираемой предприятием выше сброса. Какова допустимая концентрация фенола в сточных водах, если ПДК = 0,001 мг/л достигается в створе полного перемешивания (γ = 1), а расход сточных вод составляет q = 2,1 м3/с?
Решение:
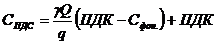 , где
, где
γ - коэффициент смешения; q - расход сточных вод составляет, м3/с; Q - расходом воды в реке, м3/с.
Т.к. ПДК достигается в створе полного перемешивания γ = 1. (СТВОР ПОЛНОГО СМЕШЕНИЯ - Ближайший к источнику, влияющему на качество воды, поперечный профиль русла водотока, в котором устанавливается практически равномерное распределение температур и концентраций веществ в воде)
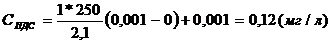
Ответ: 0,12 мг/л или 0,12 г/м3
№9
Дать оценку уровня загрязнения воздуха:
| Обозначение | CO | пыль | NO2 | NH3 |
| Концентрация, С, мг/м3 | 0,01 | 0,8 | 0,002 | 0,01 |
| ПДК, мг/м3 | 0,5 | 0,2 | 0,2 |
Решение: Концентрация каждого из ЗВ не превышает норм ПДК, но т.к. перечисленные вещества обладают эффектом суммации, то должно соблюдаться условие норм качества АВ:
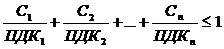
№10
Рассчитайте, какова концентрация СО в помещении, если при пропускании воздуха объемом 2 л через оксид йода (V) образовалось 0,036 мг йода. Ответ: 3,55⋅10–7 моль/л.
Решение:
5CO + I2O5 = I2 + 5CO2↑
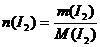
где n – число молей,
m – масса вещества в г (0,036 мг = 0,036/1000 г.)
М – молярная масса вещества, (М(I2) = 2*127= 254 г/моль)

Из уравнения видно, что на 1 моль выделившегося йода, приходится 5 молей поглощенного СО, следовательно, всего при пропускании 2 л воздуха поглотилось угарного газа:
1,417*10-7 * 5 = 7,1*10-7 (моль)
Т.о. (поскольку всего было пропущено 2 л воздуха) концентрация в воздухе составит:
(7,1*10-7) / 2 = 3,55*10-7 (моль/л)
Ответ: 3,55⋅10–7 моль/л.
№ 11.
Химкомбинат по производству азотных удобрений из-за поломки главного конвейера допустил сброс нитрата аммония в близлежащее озеро. Выживут ли ушастые окуни, живущие в озере, если известно, что сбросили 30 т нитрата аммония, а объем озера - 5 тыс. л. Токсическая концентрация нитрата аммония для ушастых окуней составляет 800 мг/л. Ответ: 6⋅106 мг/л.
Решение:
Рассчитаем концентрацию аммонийной селитры в озере после поступления загрязнения:
С (NH4NO3) = m(NH4NO3) /V(воды)
m(NH4NO3) = 30 т = 30*109 мг
V(воды) = 5000 л
С (NH4NO3) = 30 *109 / 5000 = 6*106 (мг/л) Следовательно, рыба в водоеме погибнет.
№12
Согласно ОВОС ( оценка воздействия на окружающую среду) предприятие будет выбрасывать в атмосферный воздух загрязняющие вещества.
| ЗВ, мг/м3 | ПДК, мг/м3 | Содержание в зоне возможного строительства предприятия, мг/м3 | Выбрасываемая концентрация, мг/м3 | |
| NO2 | 0,2 | 0,15 | 0,1 | |
| SO2 | 0,5 | 0,35 | 0,25 | |
| CO | 5,0 | 2,0 | 3,0 | |
| взвешенные вещества | 0,5 | 0,5 | 0,3 | |
| H2S | 0,008 | 0,004 | 0,002 | |
| сажа | 0,15 | 0,15 | 0,1 | |
| алканы | 1,0 | 0,5 | 0,5 |
Возможно ли размещение данного предприятия на данной территории.
Решение
| ЗВ, мг/м3 | ПДК, мг/м3 | Сз.в./ПДК | Сфон./ПДК | ||
| NO2 | 0,2 | 0,15/0,2 = 0,75 | 0,1/0,2=0,5 | 0,75+0,5=1,25 | |
| SO2 | 0,5 | 0,35/0,5=0,7 | 0,25/0,5=0,5 | 0,7+0,5=1,2 | |
| CO | 5,0 | 2,0/5=0,4 | 3,0/5=0,6 | 0,4+0,6=1,0 | |
| Взвеш. вещества | 0,5 | 0,5/0,5=1,0 | 0,3/0,5=0,6 | 1,0+0,6=1,6 | |
| H2S | 0,008 | 0,004/0,008=0,5 | 0,002/0,008=0,25 | 0,5+0,25=0,75 | |
| сажа | 0,15 | 0,15/0,15=1 | 0,1/0,15=0,6 | 1+0,6=1,6 | |
| алканы | 1,0 | 0,5/1=1 | 0,5/1=0,5 | 1+0,5=1,5 |
Сумма отношений концентраций выбрасываемого ЗВ и фоновой концентрации каждого из них в воздухе к их ПДК не должна превышать единицы.
Поскольку в нашем случае наблюдается превышение, то строительство предприятия проводить нельзя.
№13
В реку с расходом воды Q = 310 м3/с сбрасываются сточные воды предприятия, содержащие бензол, которого нет в исходной воде, забираемой предприятием выше сброса. Какова величина ПДС, если расход сточных вод составляет q = 6,1 м3/с, вода используется в культурно-бытовых целях, а ПДК = 0,5 мг/л достигается в створе полного перемешивания (γ = 1),?
Решение:
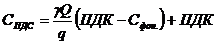 (мг/л или г/м3), где
(мг/л или г/м3), где
γ - коэффициент смешения; q - расход сточных вод составляет, м3/с; Q - расходом воды в реке, м3/с.
№14.
Рассчитать геометрические параметры решетки (ширину и число прозоров между стержнями решетки) для станции производительностью Q = 2500 м3 / час, при скорости потока воды через решетку V = 0,9 м / с; глубине канала подвода воды на очистку h = 2 м; ширине прозоров между стержнями решетки b = 20 мм; толщине стержня s = 10 мм. Коэффициент, учитывающий стеснение прозоров граблями и задержанными загрязнителями равен k = 1,05.
Решение:
Произведем пересчет расхода воды: 2500 /(60*60) = 0,6944 м3/с
Определение числа прозоров решетки n:
n=  ;
;
где Q - расход воды, м3/с; Vср - средняя скорость движения воды в трубопроводе, м/с.
Общая ширина решетки определяется по формуле Вр, м:
Вреш. = b*n + s*(n – 1),
где s − толщина прутка.
Вреш = 0,020*20 + 0,010 (20 – 1) = 0,59 м
№15.
Рассчитать геометрические параметры решетки (ширину и число прозоров между стержнями решетки) для станции производительностью Q = 2000 м3/час., при скорости потока воды через решетку V = 0,8 м/с; глубине канала подвода воды на очистку h = 2,5 м; ширине прозоров между стержнями решетки b = 16 мм; толщине стержня s = 30 мм. Коэффициент, учитывающий стеснение прозоров граблями и задержанными загрязнителями равен k = 1,05.
Решение – аналогично 15.
№16
Какова зона активного загрязнения атмосферы, м, для Сl2, при средней высоте источника выброса Cl2 10 м и температуре смеси на выходе из источника выброса 500С и температуре окружающего воздуха 250С.
Решение:
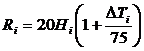 , где
, где
Ri – зона активного загрязнения атмосферы i-тым компонентом, м; Hi - средней высоте источника выброса i-того компонента, м; ∆Ti – разность температуры газового выброса и окружающей среды (∆Ti = Твыбр.-То.с.), 0С.
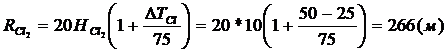
Ответ: 266 м.
№17.
При анализе воздуха на содержание ксилола по реакции с формальдегид серной кислотой отбор проб осуществлялся при помощи жидкостных поглотителей Полежаева, заполненных 4 мл четыреххлористого углерода. Пробы отбирались со скоростью 1л/мин в течение 2 минут. Температура воздуха в помещении - 18°С, давление 748 мм рт. ст. Полученное значение содержания ксилола в пробе составило 0,008 мг. Рассчитать концентрацию ксилола в исследуемом воздухе и определить степень его загрязненности, если ПДК для ксилола равно 50 мг/м3. Ответ: 3,81 мг/м3.
Решение:
Поскольку скорость пробоотбора составляет 1л/мин, то за 2 мин. будет соответственно отобрано 2 л воздуха.
Т.к. физические условия в помещении отличаются от стандартных, приведем объем воздуха к нормальным условиям согласно на законам Бойля-Мариотта и Гей-Люссака:
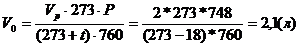
V 0 — объем газа при 0 °С и 760 мм рт. ст., м³;
V P — объем газа в рабочих условиях, м³;
р — абсолютное давление газа в рабочих условиях, мм рт. ст.;
Т — абсолютная температура газа в рабочих условиях, °К.
Результаты анализа вычисляют по формуле: Х = a*1000 / V0,
где a - количество вещества, найденное во всем объеме исследуемого раствора, мг; V0 - объем исследуемого воздуха, приведенного к нормальным условиям, л.
Х = (0,008*1000)/2,1 = 3,81 мг/м3
Ответ: 3,81 мг/м3, значение не превышает норм ПДК.
№ 18
Для определения максимальной разовой концентрации аммиака исследуемый воздух со скоростью 1 л/мин в течение 30 минут протягивают через поглотительный прибор, содержащий 6 мл 0,02 н серной кислоты. После проведения аналитической реакции по калибровочному графику, концентрация аммиака в пробе составила 0,8 мкг. Рассчитать максимальную разовую концентрацию аммиака в исследуемом воздухе, если отбор пробы проводился при 25°С и давлении 770 мм рт. ст. Ответ: 0,0287 мг/м3.
Решение:
Поскольку скорость пробоотбора составляет 1л/мин, то за 30 мин. будет соответственно отобрано 30 л воздуха.
Т.к. физические условия в помещении отличаются от стандартных, приведем объем воздуха к нормальным условиям согласно на законам Бойля-Мариотта и Гей-Люссака:
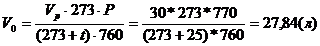
V 0 — объем газа при 0 °С и 760 мм рт. ст., м³ (стандартные условия);
V P — объем газа в рабочих условиях, м³;
р — абсолютное давление газа в рабочих условиях, мм рт. ст.;
Т — абсолютная температура газа в рабочих условиях, °К.
Результаты анализа вычисляют по формуле: Х = a/ V0,
где a - количество вещества, найденное во всем объеме исследуемого раствора, мкг; V0 - объем исследуемого воздуха, приведенного к нормальным условиям, л.
Х = 0,8/27,84 = 0,0287 мг/м3
Ответ: 0,0287 мг/м3
№19. Рассчитать необходимое число песколовок при нужной степени очистки 99,8% если степень на одной песколовке очистки α=70%, концентрация ЗВ Cн = 8,0 г/л.
Решение:
Конечная концентрация после очистки на 99,8% должна составлять
Ск= Сн – α*Сн
Ск= Сн – α*Сн = 8 -0,998*8=0,016 (г/л)
рассчитаем песколовок, после которых достигается нужная степень очистки(Сконечная):
Ск1= Сн – α*Сн
Ск2= Ск1 – α * Ск1
Ск3= Ск2 – α * Ск2
Ск4= Ск3 – α * Ск3
Ск5= Ск4 – α*Ск4 и т.д.
Ск1= Сн – α*Сн = 8 - 0,7*8=2,4 г/л;
Ск2= Ск1 – α * Ск1= 2,4 - 0,7*2,4=0,72 г/л;
Ск3= Ск2 – α * Ск2= 0,72 - 0,7*0,72=0,18 г/л;
Ск4= Ск3 – α * Ск3= 0,18 - 0,7*0,18=0,054 г/л.
Ск5=Ск4–α*Ск4=0,054–0,7*0,054=0,0162г/л
Т.е. необходимы 5 песколовок.
№20
Определить степень очистки газа в скруббере при выполнении условий и дать рекомендации:
| Фракции аэрозолей, мкм | 0 - 5 | 5 - 10 | 20 - 30 | 40 - 60 |
| % содержания фракций | ||||
| Фракционная степень очистки, %, hj | 99,9 |
Решение:
η = Σ ηi  ; %
; %
где η – степень очистки %, ηi – фракционная степень очистки; φi – содержание частиц данной фракции, %
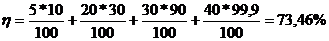
№21
Определить степень очистки газа в скруббере при выполнении условий и дать рекомендации:
| Фракции аэрозолей, мкм | 0 - 5 | 5 - 10 | 20 - 30 | 40 - 60 |
| % содержания фракций | ||||
| Фракционная степень очистки, %, hj | 99,9 |
Аналогично – 21
№ 22
Кислотные дожди попадают в почву и разрушают нерастворимые соединения металлов, например оксиды. Таким образом, тяжелые металлы в избыточных количествах попадают в воду, а затем в кровь животных и человека, вызывая различные заболевания и массовую гибель рыбы. В состав глины входит 10-40 % оксида алюминия. Какое количество алюминия окажется в воде, если вместе с осадками выпало 10 т серной кислоты. Ответ: 3,6735 тонн.
Решение: 2Al2O3+3H2SO4 = 2Al2(SO4)3 + 6H2O
2Al2O3+6H+ = 4Al3+ + 6H2O
Как видно из уравнения реакции 3 моля серной кислоты взаимодействуют с 2 молями оксида алюминия, которые в свою очередь содержат 4 атома алюминия.
Рассчитаем массу 3 молей серной кислоты и 4 молей алюминия:
m(H2SO4) = n(H2SO4) *M(H2SO4) = 3*(2*1+32+16*4) = 3*98 = 294
m(Al) = n(Al)*Ar(Al) = 4*27 = 108
Составим пропорцию:
294 г (H2SO4) – 108 г (Al)
10 т (H2SO4) – Х т (Al)

№23
Определите молярную концентрацию хлора в воде, если для его удаления из воды объемом 1 м3 потребовался раствор тиосульфата натрия объемом 500 мл (с = 0,1 моль/л). Ответ: 5⋅ 10–4 моль/л.
Решение:
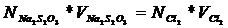 , где
, где
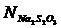 - нормальная концентрация тиосульфата натрия, моль/л;
- нормальная концентрация тиосульфата натрия, моль/л; 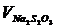 - объем раствора тиосульфата натрия, мл;
- объем раствора тиосульфата натрия, мл; 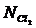 - нормальная концентрация хлора, моль/л;
- нормальная концентрация хлора, моль/л; 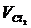 - объем воды содержащей хлор, мл
- объем воды содержащей хлор, мл
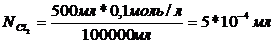
№ 24
№ 25