Цель работы.
Целью данной работы является изучение адсорбции органических веществ из их водных растворов активированным углём.
Приборы и материалы.
Изучается адсорбция из водных растворов органических кислот и спиртов на поверхности активированного угля. В работе используются бутыли с кислотой, водой и раствором щелочи, снабженные мерными бюретками, капельница с фенолфталеином, конические колбы, воронки, пипетка, фильтровальная бумага.
Порядок выполнения работы.
Равновесную концентрацию растворов определяют двумя методами.
Вариант 1.
В данном варианте работы в качестве объекта исследования выбраны
органические кислоты, изменение концентрации которых, необходимое для вычисления удельной адсорбции Г, определяется методом титрования.
В восемь сухих конических колбочек, пронумерованных с 1 по 8,
помещаютвзвешенные на торсионных весах навески активированного углявеличиной около 400 мг. Точные значения навески угля записывают в таблицу 6.1.В каждую колбу с углём наливают 25 мл указанной в задании органическойкислоты. В лаборатории кафедры имеются растворы кислот четырёхконцентраций. Эти растворы наливают в колбы с углём с 1 по 4 по 25 мл раствора в каждую колбу. Содержимое колб перемешивают и отмечают время начала адсорбции. Через 10-15 минут в каждую из четырёх оставшихся колб с навесками (с 5 по 8) наливают сначала 12,5 мл воды, а затем 12,5 млимеющихся 4 кислот. Время начала адсорбции в колбах с 5 по 8 также заносят в таблицу 4. Содержимое колб периодически перемешивают. По окончании указанного в задании времени адсорбции (например, 45 минут) растворы из колб с 1 по 4 отфильтровывают через складчатые бумажные фильтры. Первые порции фильтрата (5 мл) выливают, т.к. в нихконцентрацияпонижена вследствие
адсорбции кислоты фильтровальной бумагой.
Таблица 6.1 - Экспериментальные данные.
| Номера колб | ||||||||
| Навеска угля,мг | ||||||||
| Концентрация кислоты С, кмоль/м3 | ||||||||
| Время начала адсорбции | ||||||||
| Время окончания адсорбции |
Послеокончания адсорбции в колбах 5-8 с их содержимым проводят те же операции.Затем определяют равновесные концентрации растворов кислот после адсорбции. Для этого из каждого раствора в чистые колбочки отбирают 2-3 пробы по 5 мл и титруют раствором едкого натра с концентрацией 0,1 кмоль/м3 с фенолфталеином в качестве индикатора дополучения совпадающих результатов.
По объёму V щелочи, пошедшей на титрование 5 мл растворакислоты,рассчитывают равновесную концентрацию кислоты после адсорбции: 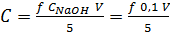 (6.1)
(6.1)
где f - коэффициент, равный 1 для одноосновной кислоты и равный
0,5 -для двухосновной.
Удельную адсорбцию Г рассчитывают по формуле (5.2), в которой
С0 - концентрация кислоты после адсорбции, V - объём раствора кислоты,
Таблица 6.2 – Экспериментальные и расчетные данные.
| Номера колб | Со, кмоль/м3 | V, см3 | С, кмоль/м3 | Г, кмоль/кг | С /Г |
изкоторого происходила адсорбция (в нашем случае V = 25.10-6м3), m – навеска адсорбента в кг. Экспериментальные данные и результаты вычислений записывают в таблицу 6.2.
Вариант 2.
В этом варианте работы концентрация раствора кислоты после адсорбции определяется по величине поверхностного натяжения раствора. Этот вариант работы обычно выполняет студент, проделавший на предыдущем занятии лабораторную работу 1 и получивший зависимость σ = ƒ(С) для растворов данной кислоты.
Приготовление растворов кислоты и адсорбцию из них на активированном угле проводят по методике, описанной в варианте 1. Равновесные концентрации растворов кислоты после адсорбции определяют по величине поверхностного натяжения растворов. Для этогоизмеряютповерхностноенатяжение отфильтрованных растворов, пользуясь методом максимального давления в газовом пузырьке (см. работу 1). Измерения начинают с самогоразбавленногораствора.Перед измерением σ следующегораствораколбочку 1 и пипетку 2 (рисунок 4.1) споласкивают раствором следующей концентрации. Полученные опытные данные заносят втаблицу 6.3.
Таблица 6.3 - Экспериментальные и расчётные данные.
| Номер колбы | ||||||||
| Н.,мм 1изм. 2изм. 3изм. | ||||||||
| Нср.103,м | ||||||||
| σ.103, Н/м | ||||||||
| С, моль/л | ||||||||
| Г, кмоль/кг | ||||||||
| С/Г |
Оформление результатов работы.
По формуле (5.2) вычисляют удельную адсорбцию, строят изотерму адсорбции Г= f(С) (С - равновесная концентрация раствора кислоты после
адсорбции), и проверяют полученные результаты у преподавателя. Затем проверяют применимость уравнения Ленгмюра (3.13) к опытным данным.
Уравнение (3.13) простыми преобразованиями приводится к следующему линейному виду:
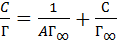 (6.2)
(6.2)
 В этом уравнении прямой линии y = b0 + b1x y = C/Г, x = С, начальный коэффициент прямой b0= 1/(Г∞А) и угловой коэффициент b1=1/Г∞.С/Г
В этом уравнении прямой линии y = b0 + b1x y = C/Г, x = С, начальный коэффициент прямой b0= 1/(Г∞А) и угловой коэффициент b1=1/Г∞.С/Г
 |
Δ(С/Г) 

bо
 С
С
. ΔС
Рис.6.1 - График линейной формы уравнения Ленгмюра.
По опытным данным Г = f(С) рассчитывают С/Г и строят графикзависимости С / Г = f(С) (рисунок 6.3.1). Линейный характер этой зависимостисвидетельствует о применимости уравнения (3.13). В этом
случае по угловому коэффициенту прямой b1= Δ(С/Г)/ΔС = 1/ Г∞ вычисляютпредельную адсорбцию Г∞ и по ней - удельную поверхность адсорбента: Sуд= S0Γ∞Na, (6.3)
где S0 = 20.10-20м2- площадь, занимаемая одной молекулой кислоты в
адсорбционном монослое,
Na = 6,02 .1026 кмоль-1.
Приложение
(обязательное)
Пример обработки опытных данных σ = f (x)
В качестве объекта выбран водный раствор гексилового спирта. Изотерма поверхностного натяжения раствора этого ПАВ при 200С приведена в таблице 7.1. Растворимость гексанола в воде при 200С равна хS = 0,00125. Плотность гексанола ρ = 0,832 103 кг/м3.
Таблица 7.1 - Опытные данные и результаты их обработки.
| х | σ, н/м | Δσ, н/м | x /Δσ (н/м)-1 | Г.109, кмоль/м2 |
| 0,0728 | ||||
| 4,41 10-5 | 0,0663 | 0,0065 | 0,00679 | 2,39 |
| 8,82 10-5 | 0,0604 | 0,0124 | 0,00712 | 3,83 |
| 0,000125 | 0,0568 | 0,016 | 0,00783 | 4,60 |
| 0,000176 | 0,0529 | 0,0199 | 0,00887 | 5,24 |
| 0,000295 | 0,0467 | 0,0261 | 0,0113 | 5,77 |
| 0,000441 | 0,0412 | 0,0316 | 0,014 | 5,67 |
| 0,000565 | 0,0372 | 0,0356 | 0,0159 | 5,40 |
| 0,000882 | 0,0314 | 0,0414 | 0,0213 | 4,60 |
Первоначально проверяют применимость к опытным данным σ = ƒ (х) выражения(3.15). С этой целью рассчитывают х/Δσ при различныхконцентрациях х (3-тий и 4-тый столбцы таблицы 7.1)истроят графикзависимости х/Δσ = ƒ(х) (рисунок 7.1). В случае
применимости выражения(3.15)указанный график должен представлять собой прямую линию с начальным bо иугловым b1 коэффициентами.
Как видно из рисунка 7.1, зависимость х/Δσ = ƒ(х) близка клинейной.
Начальный коэффициент этой прямой bо равен отрезку, отсекаемому прямой линией на оси х / Δσ при х = 0: bo = 0,0059м/Н. Угловой
Продолжение приложения
х/Δσ
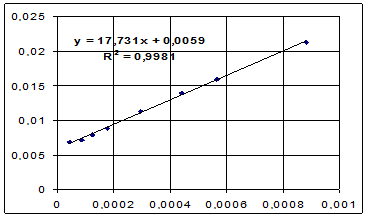 х
х
Рисунок7.1. График для проверки формулы (3.15).
коэффициент прямойравен b1= 17,73м/Н. По коэффициентам b0 и b1 рассчитывают константы а и b по формулам: а =b1/bо = 3005 и b = 1/b1 =0,0564 Н/м. Затем по уравнениюизотермы адсорбции (3.17)
рассчитывают удельную адсорбцию Г и строят график зависимости
Г, кмоль/м2
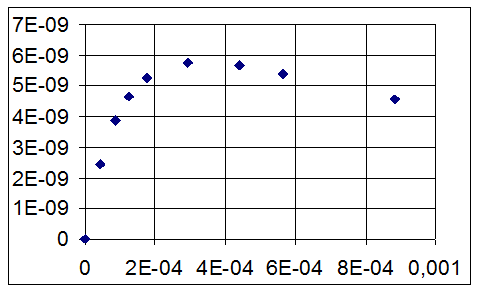
х
Рисунок 7.2. Изотерма адсорбции гексанола на границе раздела ж-г.
Продолжение приложения
Г = ƒ(х) –изотермуадсорбции (рисунок 2).
Далее основываясь на формуле (3.20) рассчитывают толщину поверхностного слоя растворов гексанола. Молярные объёмы гексанола и воды равны, соответственно v1= М1/ρ1 = 0,1249 м3/кмоль и v2=М2/ρ2 = = 0,018 м3/кмоль. Предполагая у = хS рассчитывают толщину поверхностного слоя вовсём изученном диапазоне концентраций. Результаты расчётов приводят в таблице 7.2.
По формуле (3.22) рассчитывают минимальную возможную толщинуповерхностного слоя z1. Результаты расчётов заносят в таблицу 7. 2.
Таблица 7.2 - Толщина поверхностного слоя растворов гексанола.
| х .105 | 4,41 | 8,82 | 12,5 | 17,6 | 29,5 | 44,1 | 56,5 | 88,2 |
| z.108, м | 3,64 | 6,04 | 7,47 | 8,89 | 10,9 | 12,7 | 14,2 | 22,4 |
| z1 108, м | - | - | - | - | - 1,75 | 3,51 | 4,64 | 4,34 |
Как видно из таблицы 7.2, минимальная возможная толщина (z1) имеет физический смысл только при концентрациях раствора больших 2,95 10-4; при меньших концентрациях она отрицательна.
Далее рассчитывают 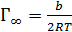 =1,16 10–9кмоль/м2,площадь, занимаемуюодной молекулой ПАВ в насыщенном монослое, So = (
=1,16 10–9кмоль/м2,площадь, занимаемуюодной молекулой ПАВ в насыщенном монослое, So = (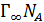 )-1 = 1,43 10-19м2и толщину монослоя δ =
)-1 = 1,43 10-19м2и толщину монослоя δ = 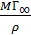 = 1,44 10-9м.Таким образом, толщина поверхностного слоя, как следует из данных таблицы 7.2, существенно больше толщины насыщенного монослоя.
= 1,44 10-9м.Таким образом, толщина поверхностного слоя, как следует из данных таблицы 7.2, существенно больше толщины насыщенного монослоя.
Если в координатах х/Δσ = ƒ(х) точки не ложатся на прямую линию, при вычислении удельной адсорбции применяют графический метод.
Литература
1Фридрихсберг, Д.А. Курс коллоидной химии: учебник для вузов / Д.А. Фридрихсберг. - СПб.: Химия, 1995.-400 с.
2 Фролов, Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. Учебник для вузов / Ю.Г. Фролов.-М.: Химия, 1989. -464 с.
3 Практикум по коллоидной химии: учебное пособие / В.И. Баранова [и др.]: под ред. В.И. Барановой. - М.: Высшая школа, 1983. –215с.
4Воюцкий, С.С. Kvpc коллоидной химии: учебник для вузов / С.С.Воюцкий. - М.: Химия, 1987.– 312 с.
5 Наумов, В.Н. Краткий коллоидно-химический словарь: справочное пособие / В.Н. Наумов, В.А. Малов. - СПб.:СПбГТИ(ТУ), 2003.- 40 с.
6 Малов, В.А. Математическое обеспечение некоторых коллоидно-химических расчетов на ЭВМ: методические указания / В.А. Малов – Л.: Изд-во ЛТИ им. Ленсовета,1988.- с.36.
Кафедра физической химии