Транспорт газов (кислорода из легких к тканям, где он отчасти потребляется) и углекислого газа (из тканей, где он образуется в результате окислительных процессов, к легким) осуществляется кровью, движение которой обеспечивается благодаря ритмичной деятельности сердца. Таким образом, реализация процесса транспорта газов кровью во многом зависит от функционального состояния аппарата кровообращения.
Газы могут находиться в крови в двух состояниях:
Ø физического растворения в плазме крови (обычно очень небольшое количество газа)
Ø химически связанном виде.
Причем после перехода газа в кровь он сначала растворяется в плазме крови, а затем уже связывается с теми или иными химическими веществами. Скорость связывания газа кровью будет во многом определять интенсивность его последующей диффузии в кровь (поскольку в результате химического связывания газа концентрация его свободной фракции в крови снижается, и это облегчает дальнейшую диффузию новых молекул данного газа в кровь). Кислород связывается с гемоглобином эритроцитов (с гемом гемоглобина), а углекислый газ – с водой (в результате чего образуются бикарбонат-ионы) и гемоглобином (белковой его частью). Диффузия кислорода из крови в межклеточную жидкость или углекислого газа из крови в альвеолярный воздух осуществляется за счет свободных их форм (физически растворенных). Причем по мере уменьшения концентрации физически растворенных газов в плазме происходит высвобождение части их молекул из химически связанного состояния (т.е. переход их в свободную форму) и последующая диффузия из крови.
Концентрация кислорода в артериальной крови в среднем составляет 19об% (19мл/100мл крови), большая часть его находится в состоянии химически связанном с гемоглобином (в виде оксигемоглобина) и очень небольшая (всего 0,3 мл кислорода) – в свободном виде (растворена в плазме крови). Поступающий из альвеолярного воздуха в кровь кислород вначале растворяется в плазме, а затем диффундирует в эритроциты, где быстро присоединяется к гемоглобину. Поскольку скорость связывания кислорода гемоглобином очень велика, то концентрация свободного гемоглобина в эритроцитах оказывается ничтожно малой, что облегчает и ускоряет диффузию в них кислорода из плазмы крови. Гемоглобин является сложным белком, состоящим из небелковой части (гема) и белковой части (глобина). Причем в состав каждой молекулы гемоглобина входит 4 глобиновые субъединицы, каждая из которых ассоциирована с одной молекулой гема. Кислород присоединяется к железу гема (при этом атом железа после присоединения кислорода не изменяет свою валентность). Поскольку в составе молекулы гемоглобина насчитывается 4 молекулы гема, то соответственно одна молекула гемоглобина может присоединять 4 молекулы кислорода. Кривая диссоциации оксигемоглобина, отражающая зависимость его концентрации от парциального напряжения кислорода в плазме крови, имеет S-образный вид, что свидетельствует в пользу кооперативного характера связывания кислорода гемоглобином. Кооперативность связывания кислорода гемоглобином заключается в том, что присоединение одной молекулы кислорода к одному из гемов гемоглобина приводит к такому изменению конформации макромолекулы, при котором облегчается и ускоряется присоединение остальных молекул кислорода к оставшимся гемам гемоглобина. Нижняя часть кривой диссоциации оксигемоглобина, соответствующая диапазону низких парциальных напряжений кислорода в крови (типичных для периферических тканей), является крутой, а верхняя, соответствующая диапазону высоких парциальных напряжений кислорода в крови (типичных для капилляров легких) – пологой. Таким образом, при низких парциальных напряжениях кислорода в плазме крови имеет место диссоциация оксигемоглобина, и концентрация его в эритроцитах снижается (соответственно увеличивается концентрация дезоксигемоглобина). Причем скорость диссоциации оксигемоглобина будет тем больше, чем ниже парциальное напряжение кислорода в плазме крови и окружающих тканях. Некоторые вещества (2,3-дифосфоглицерат, концентрация которого в эритроцитах повышается при снижении парциального напряжения кислорода в крови, ионы водорода, а также повышение температуры) обладают способностью снижать сродство гемоглобина к кислороду, что будет обеспечивать более высокий уровень диссоциации оксигемоглобина.

Рис. 8. Кривые диссоциации оксигемоглобина
I – кривая насыщения гемоглобина кислородом при нормальном содержании СО2
II – влияние изменения парциального напряжения СО2 на кривую диссоциации оксигемоглобина
При высоких парциальных напряжениях кислорода в плазме крови происходит связывание его гемоглобином с образованием оксигемоглобина. Причем вначале по мере увеличения парциального напряжения кислорода в плазме концентрация оксигемоглобина в крови резко увеличивается, и при парциальном напряжении 60 мм.рт.ст. достигается почти 90% насыщение гемоглобина кислородом. Дальнейшее же увеличение парциального напряжения кислорода в плазме мало влияет на концентрацию оксигемоглобина (кривая принимает отлогий вид). Следовательно, концентрация оксигемоглобина в артериальной крови при парциальном давлении кислорода в альвеолярном воздухе, равном 60 мм.рт., уже приближается к максимальному насыщению (достигается 90% насыщение гемоглобина кислородом), тогда как нормальное парциальное давление кислорода в альвеолярном воздухе (при нормальном процентном его содержании в атмосферном воздухе, соответствующим 21%) составляет 100 мм.рт.ст. Из сказанного следует, что изменения парциального давления кислорода в альвеолярном воздухе в диапазоне 60-100 мм.рт.ст. мало отражаются на концентрации окисгемоглобина в крови и кислородном снабжении тканей.
Максимальное количество кислорода, которое может связать кровь, характеризует кислородную емкость крови, которая во многом зависит от концентрации гемоглобина в ней. Часть кислорода, поглощаемая периферическими тканями из артериальной крови, отражает коэффициент утилизации кислорода тканями, который рассчитывается по следующей формуле:
К утилизации О2 = 
где К утилизации О2 – коэффициент утилизации кислорода тканями
РО2артер и РО2веноз – парциальное напряжение кислорода в артериальной и венозной крови соответственно.
Коэффициент утилизации кислорода периферическими тканями находится в пределах от 30 до 40% (причем его величина для разных тканей различна и во многом зависит от уровня обменных процессов в них). При тяжелой мышечной работе коэффициент утилизации кислорода повышается до 60%.
Концентрация углекислого газа в венозной крови составляет 58об% (58мл/100мл крови), из которых большая часть (55,5об%) находится в химически связанном виде (4,5об% в виде карбгемоглобина (причем СО2 присоединяется к белковой части гемоглобина, и каждая молекула гемоглобина может присоединить 4 молекулы углекислого газа) и 51об% в виде бикарбонатов) и только 2,5об% углекислого газа транспортируется в состоянии физического растворения. Углекислый газ образуется в клетках периферических тканей в ходе окислительных процессов и по градиенту парциального напряжения поступает в кровь капилляров большого круга кровообращения, где сначала растворяется, а затем диффундирует в эритроциты. Небольшая часть этого углекислого газа присоединяется к гемоглобину, а большая – под действием фермента угольной ангидразы связывается с водой, превращаясь в угольную кислоту (угольная ангидраза имеется только в эритроцитах и ускоряет процесс образования угольной кислоты в 20000 раз). Одновременно с образованием угольной кислоты из крови в периферические ткани переходит кислород, что сопряжено с диссоциацией оксигемоглобина и образованием дезоксигемоглобина (гемоглобина, отдавшего кислород). Если оксигемоглобин обладает более сильными кислотными свойствами, чем угольная кислота, то дезоксигемоглобин – напротив, является более слабой кислотой по сравнению с угольной. В связи с этим усиленно образующаяся на уровне тканей угольная кислота начинает обменивать свои ионы Н+ на ионы К+, ассоциированные с дезоксигемоглобином, в результате чего образуется бикарбонат калия и восстановленный дезоксигемоглобин (ННв). Бикарбонат-ионы частично переходят из эритроцита в плазму крови (в обмен на проникающие в эритроцит ионы Сl-), где связываются с натрием. Следовательно, диссоциация оксигемоглобина на уровне тканей, сопровождающаяся отдачей тканям кислорода, облегчает и улучшает связывание кровью углекислого газа (поскольку образующийся дезоксигемоглобин, как более слабая кислота, начинает обмениваться ионами К+ с угольной кислотой, способствуя образованию бикарбонатов и связыванию таким образом углекислого газа). Данный эффект, отражающий зависимость скорости связывания углекислого газа кровью от интенсивности отдачи кислорода, носит название эффекта Холдена.
На уровне капилляров легких венозная кровь постепенно насыщается кислородом. При этом образуется оксигемоглобин, который, являясь более сильной кислотой, чем угольная, начинает вытеснять из бикарбонатов ионы К+, что, в конечном итоге, сопровождается образованием
Ø во-первых, калиевой соли оксигемоглобина
Ø а во-вторых, свободной угольной кислоты, которая, являясь нестойкой, распадется на углекислый газ и воду; углекислый газ диффундирует сначала из эритроцита в плазму крови, а затем в альвеолярный воздух.
Таким образом, связывание кровью кислорода на уровне капилляров легких облегчает отдачу ею углекислого газа, поскольку образующийся оксигемоглобин вытесняет ионы калия из бикарбонатов, способствуя их превращению в угольную кислоту, распадающуюся на углекислый газ и воду.
Схематическое представление связывания углекислого газа и отдачи кислорода кровью на уровне капилляров большого круга кровообращения и обратных процессов в капиллярах малого круга кровообращения
На уровне капилляров периферических тканей (капилляров большого круга кровообращения) часть оксигемоглобина, находящегося в эритроцитах в виде калиевой соли (КНbО2), диссоциирует, отдавая кислород и превращаясь в дезоксигемоглобин (КНb):
 КНbО2 КНb+О2 (процесс происходит в эритроците, О2 диффундирует из крови в ткани)
КНbО2 КНb+О2 (процесс происходит в эритроците, О2 диффундирует из крови в ткани)
Но дезоксигемоглобин является гораздо более слабой кислотой, чем оксигемоглобин, и обладает более слабыми кислотными свойствами по сравнению с угольной кислотой. В результате этого он начинает обменивать ионы К+ на ионы Н+ угольной кислоты, которая интенсивно образуется в эритроцитах на уровне тканей вследствие поступления СО2 из тканей в кровь:
 СО2+Н2О Н2СО3 (процесс происходит в эритроците и катализаруется угольной ангидразой: СО2 вначале поступает из тканей в плазму крови, а из плазмы в эритроцит, где связывается с водой)
СО2+Н2О Н2СО3 (процесс происходит в эритроците и катализаруется угольной ангидразой: СО2 вначале поступает из тканей в плазму крови, а из плазмы в эритроцит, где связывается с водой)
 КНb+Н2СО3 ННb+КНСО3 (процесс происходит в эритроците, ионы НСО3- из эритроцитов частично переходят в плазму крови, где ассоциируются с ионами натрия)
КНb+Н2СО3 ННb+КНСО3 (процесс происходит в эритроците, ионы НСО3- из эритроцитов частично переходят в плазму крови, где ассоциируются с ионами натрия)
Таким образом, калиевая соль дезоксигемоглобина, проявляя слабые щелочные свойства, является акцептором протонов водорода и, присоединяя их, превращается в ННb (восстановленный дезоксигемоглобин); при этом угольная кислота, усиленно образующася в эритроцитах капилляров большого круга кровообращения, превращается в бикарбонат-ион (НСО3-), ассоциированный в эритроцитах с ионами К+, а в плазме крови с ионами Na+.
На уровне капилляров малого круга кровообращения происходит насыщение крови кислородом, в результате чего бóльшая часть дезоксигемоглобина превращается в оксигемоглобин, который являясь более сильной кислотой, чем угольная, начинает вытеснять ионы К+ из бикарбонатов (при этом бикарбонат-ион присоединяет ионы Н+ и превращается в угольную кислоту, которая, являясь нестойкой, диссоциирует на СО2 и воду; углекислый газ диффундирует из эритроцита в плазму крови, а затем – в альвеолярный воздух):

|


 ННbО2+КНСО3 КНbО2+Н2СО3
ННbО2+КНСО3 КНbО2+Н2СО3

Рис. 9. Транспорт газов кровью и газообмен в легких и тканях
Диффузия газов на уровне периферических тканей, также как и газообмен между кровью капилляров и тканями, осуществляется по градиенту их парциального напряжения. Так, парциальное напряжение углекислого газа в клетках при высоком уровне их функциональной активности может достигать 60 мм.рт.ст., а в межклеточных щелях, окружающих капилляры – 46 мм.рт.ст., тогда как в артериальной крови, притекающей к ткани – 40 мм.рт.ст. Соответственно углекислый газ будет диффундировать из клеток в межклеточные щели, а оттуда в направлении капилляров и переходить в кровь (парциальное напряжение углекислого газа в венозной крови в среднем составляет 46 мм.рт.ст.).
Парциальное напряжение кислорода в артериальной крови в среднем составляет 96 мм.рт.ст., тогда как в тканевой жидкости, окружающей капилляры – 20-40 мм.рт.ст., а в клетках самих периферических тканей (особенно в области митохондрий) может быть близко к нулю. Соответственно кислород будет диффундировать из крови в направлении клеток, где он усиленно потребляется. Градиент парциального напряжения кислорода между кровью и тканями, во многом определяющий количество переходящего в ткани кислорода, напрямую зависит от уровня обменных процессов в них.
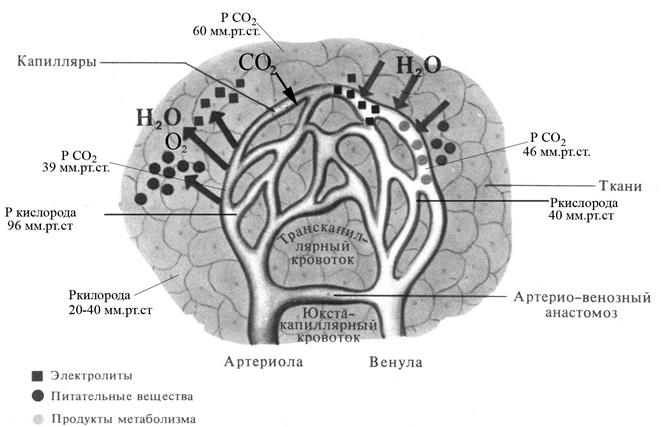
Рис. 10. Схема газообмена между капиллярами большого круга кровообращения и периферическими тканями
Регуляция дыхания
Дыхание, наряду с кровообращением, относиться к категории жизненно важных функций организма, которые осуществляются постоянно ритмически. Определяющую роль в периодической смене вдоха выдохом (т.е. в осуществлении дыхательных циклов), а также в регуляции глубины и частоты дыхания играет дыхательный центр. Причем уровень вентиляции легких (глубина и частота внешнего дыхания) во многом зависит от интенсивности обменных процессов в периферических тканях, которая отражается на газовом составе крови. Дыхательный центр постоянно подстраивает интенсивность внешнего дыхания под текущие потребности организма, обеспечивая поддержание газового состава альвеолярного воздуха в таких пределах, при которых достигается нормальное насыщение артериальной крови кислородом. Следовательно, конечным результатом деятельности дыхательного центра является поддержание газового состава артериальной крови на уровне, оптимальном для нормального протекания метаболических процессов во всех тканях организма.
Под дыхательным центром понимают совокупность нервных клеток, заложенных в разных отделах центральной нервной системы и обеспечивающих координированную ритмичную деятельность дыхательных мышц и приспособление дыхания к изменяющимся условиям внешней и внутренней среды организма. Жизненно важный дыхательный центр, который собственно обладает автоматией (способностью к самостоятельной периодической генерации возбуждений) и обеспечивает дыхательную периодику (постоянную смену вдоха выдохом и, как следствие, ритмичное осуществление дыхательных циклов, продолжительность и глубина которых может регулироваться произвольно), заложен в продолговатом мозге (в толще дна ромбовидной ямки, бульбарный дыхательный центр) и представлен двумя парами ядер:
Ø дорсальными дыхательными ядрами (совокупность нейронов, окружающих солитарное ядро), содержат преимущественно инспираторные нейроны, тогда как на долю экспираторных нейронов приходится всего 5% от общего количества нейронов этих ядер. Аксоны инспираторных нейронов вступают в синаптический контакт с мотонейронами инспираторных мышц, которые заложены в шейных (мотонейроны диафрагмы) и грудных (мотонейроны межреберных мышц) сегментах спинного мозга
Ø вентральными дыхательными ядрами (расположены в вентролатеральной области ромбовидного мозга, характеризуются довольно большой протяженностью: от ядра лицевого нерва до I шейного сегмента спинного мозга), включают в свой состав обоюдное ядро (общее двигательное ядро для языкоглоточного и блуждающего нервов, часть нейронов которого имеет отношение к иннервации мышц гортани и глотки). Большая часть нейронов этого ядра имеет отношение к экспирации и посылает свои аксоны к мотонейронам спинного мозга, иннервирующим внутренние межреберные мышцы и мышцы живота.
 Между нейронами этих двух пар дыхательных ядер существуют сложные взаимоотношения. Так, инспираторные нейроны дорсального дыхательного ядра, наряду с тем, что посылают свои аксоны в спинной мозг (к мотонейронам инспираторных мышц), отдают еще и коллатерали, вступающие в синаптический контакт с нейронами вентрального дыхательного ядра. Причем инспираторные нейроны дорсального дыхательного ядра, возбуждаясь, приводят в возбуждение и инспираторные нейроны вентрального дыхательного ядра, но при этом оказывают тормозное действие на его экспираторные нейроны. Разрушение дыхательного центра продолговатого мозга или нарушение его связи с мотонейронами дыхательных мышц спинного мозга приводит к остановке дыхания.
Между нейронами этих двух пар дыхательных ядер существуют сложные взаимоотношения. Так, инспираторные нейроны дорсального дыхательного ядра, наряду с тем, что посылают свои аксоны в спинной мозг (к мотонейронам инспираторных мышц), отдают еще и коллатерали, вступающие в синаптический контакт с нейронами вентрального дыхательного ядра. Причем инспираторные нейроны дорсального дыхательного ядра, возбуждаясь, приводят в возбуждение и инспираторные нейроны вентрального дыхательного ядра, но при этом оказывают тормозное действие на его экспираторные нейроны. Разрушение дыхательного центра продолговатого мозга или нарушение его связи с мотонейронами дыхательных мышц спинного мозга приводит к остановке дыхания.
Рис. 11. Ромбовидный мозг, вид сзади (показаны ядра дыхательного центра)
Активность дыхательного центра продолговатого мозга, в свою очередь, находится под регулирующим контролем пневмотаксического центра моста (расположен в передней части моста), который оказывает тормозное влияние на инспираторные нейроны дыхательных ядер продолговатого мозга, тем самым ограничивая (укорачивая) инспирацию. Повреждение пневмотаксического центра моста или перерезка ствола головного мозга между мостом и продолговатым мозгом не приводит к остановке дыхания, но сопровождается значительным удлинением вдохов и некоторым удлинением выдохов (в целом дыхание становится более редким). Таким образом, пневмотаксический центр моста увеличивает скорость развития инспирации, укорачивает ее продолжительность и ускоряет фазу экспирации.
Немаловажное значение в регуляции дыхания имеют и вышерасположенные отделы головного мозга и, прежде всего, гипоталамус, являющийся высшим вегетативным центром, и кора больших полушарий. Так, гипоталамус обеспечивает тонкую подстройку частоты и глубины дыхания текущим потребностям организма при выполнении сложных поведенческих актов. Например, тяжелая физическая нагрузка сопровождается, как правило, усилением дыхания (с целью увеличить его минутный объем), увеличением интенсивности сердечной деятельности, уровня теплоотдачи организмом и некоторыми другими перестройками, возникающими сочетано в результате регулирующего влияния гипоталамуса на определенные ниже расположенные центры этих функций. Корковая же регуляции активности жизненно важного дыхательного центра продолговатого мозга (которая может осуществляться как прямым способом – через кортико-бульбарные пути, так и косвенно – через посредство гипоталамуса, ретикулярной формации и некоторых других структур) обеспечивает возможность
Ø произвольного контроля над дыханием (человек может сам, т.е. произвольно, углублять, учащать ил замедлять дыхание)
Ø условнорефлекторного регулирования дыхания
Ø определенного изменения дыхания при речи и пении, мышлении, эмоциональных состояниях и т.д.
Несмотря на описанное разнообразие структур центральной нервной системы, имеющих отношение к регуляции дыхания, все же определяющую роль в постоянном циклическом его осуществлении играет бульбарный дыхательный центр, который своей деятельностью обеспечивает дыхательную периодику. Активность нейронов бульбарного дыхательного центра, обладающего автоматией, регулируется преимущественно нервным путем.
Нервная регуляция активности дыхательного центра осуществляется рефлекторно в ответ на раздражение различных рецептивных полей организма (механорецепторов аппарата внешнего дыхания, проприорецептров дыхательных мышц, хеморецепторов сосудистого русла, периферических тканей и самого продолговатого мозга, а также некоторых других рецептивных полей). Так, в крупных сосудах (дуге аорты и области каротидного синуса), многих мелких сосудах, самих периферических тканях заложены хеморецепторы (т.н. периферические хеморецепторы), адекватными раздражителями для которых выступают:
Ø уменьшение содержания кислорода в крови (гипоксемия) и тканях (гипоксия)
Ø увеличение содержания углекислого газа в крови (гиперкапния) и тканях
Ø сдвиг рН крови и межклеточной жидкости в кислую сторону.
Ø повышенная концентрация ионов Н+ в крови и межклеточной жидкости.
В самом продолговатом мозге (вблизи дыхательных ядер) находятся т.н. центральные хеморецепторы, возбуждающиеся в ответ на повышение концентрации в церебральной жидкости и артериальной крови углекислого газа и ионов Н+.
Возбуждение как периферических, так и центральных хеморецепторов оказывает активирующее влияние на бульбарный дыхательный центр, способствуя интенсификации дыхания и нормализации газового состава крови. Причем центральные хеморецепторы оказывают более выраженное влияние на деятельность дыхательного центра по сравнению с периферическими.
В стенках воздухоносных путей и некоторых структур респираторного отдела (кроме альвеол) заложены механорецепторы (рецепторы растяжения), адекватным раздражителем для которых является растяжение стенок дыхательных путей. Наличие рецепторов растяжения в аппарате внешнего дыхания обеспечивает возможность объемной обратной его связи с дыхательным центром. Возбуждение механорецептров аппарата внешнего дыхания может вызвать следующие рефлексы (впервые были описаны Герингом и Брейером в 1868г):
Ø инспираторно-тормозящий рефлекс, возникает в ответ на раздувание легких при вдохе и проявляется в прекращении вдоха и возникновении выдоха; имеет защитное значение, поскольку препятствует сильному перерастяжению легких при вдохе
Ø экспираторно-облегчающий рефлекс, возникает в ответ на раздувание легких при выдохе и проявляется в продлении экспирации и задержке очередной инспирации
Ø парадоксальный эффект Хеда, заключающийся в том, что в ответ на сильное возбуждение механорецепторов раздуванием легких кратковременно повышается активность инспираторных мышц и возникает судорожный вдох (вздох), который приводит к расправлению легких и восстановлению равномерности их вентиляции
Ø наконец, снижение активности механорецептров, возникающее во время выдоха, способствует усилению инспираторной активности и укорочению выдоха (рефлекс на спадение легких).
Наряду с типичными механорецепторами (рецепторами растяжения), во всех воздухоносных путях (в эпителиальной выстилке их слизистой оболочки и субэпителиальном слое) залегают ирритантные рецепторы, представляющие собой нечто среднее между механо- и хеморецепторами. Так, адекватными раздражителями для них может выступать как сильное перерастяжение, так и спадение легких, пары едких веществ, пылевые частицы, гистамин и некоторые другие факторы. При раздражении ирритантных рецепторов дыхательных путей пылевыми частицами или едкими веществами возникает кашель. В случае раздражения их спадением бронхов или легких рефлекторно усиливается инспираторная активность, что препятствует дальнейшему спадению легких. Возбуждение этих рецепторов сильным перерастяжением легких, напротив, усиливает экспираторную активность. Возбуждение же этих рецепторов перерастяжением легких в момент пониженной их растяжимости может привести к возникновению парадоксального эффекта Хеда.
Немаловажное значение для регуляции активности дыхательного центра имеют и проприорецепторы самих дыхательных мышц, сигнализирующие в центральную нервную систему о степени их укорочения. Благодаря отмеченной двусторонней связи между центральной нервной системой и дыхательными мышцами, дыхательный центр может постоянно регулировать и корректировать глубину дыхания.