Триацилглицерины (жиры).
Сложные эфиры — органические соединения, производные карбоновых или минеральных кислот, в которых атом водорода в карбоксильной группе заменен на углеводородный радикал. Общая формула сложных эфиров:
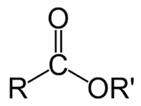 либо R1-COO-R2, где R1 и R2 — углеводородные радикалы.
либо R1-COO-R2, где R1 и R2 — углеводородные радикалы.
Сложные эфиры можно рассматривать как производные спиртов, которых атом водорода гидроксильной группы замещен на ацильный остаток. В природе наиболее распространены сложные эфиры одноатомных спиртов и низкомолекулярных кислот и сложные эфиры глицерина и высших карбоновых кислот. Воск – сложный эфир высших карбоновых кислот и высших спиртов. Пчелиный воск представляет собой мирицилпальмитат C15H31 COOC31H63
Номенклатура.
1. Способ: называется по кислотам и спиртам, входящим в их состав.
CH3COOCH3 – метиловый эфир уксусной кислоты. Уксусно-метиловый эфир
C3H7COOC2H5 – этиловый эфир бутановой (масляной) кислоты. Масляно-этиловый эфир.
2. Способ: по заместительной номенклатуре: к названию углеводородного радикала добавляется систематическое название карбоновой кислоты, суффикс «овая» кислота замещается на суффикс «оат»
HCOOCH3 -метилформиат
CH3COOCH3 – метилацетат
CH3COOC8H17 — н-октилацетт
( CH3)2CHCH2COOCH2CH2CH(CH3)2 —изоамилизовалерат (изопентилизовалерат) имеет запах яблока.
HCOOCH2C6H5 — бензилформиат; имеет запах жасмина;
HCOOCH2CH2C6H5 — 2-фенилэтилформиат имеет запах хризантем.
Изомерия. Характерна структурная изомерия спиртовых и кислотных радикалов.
CH3COOCH(CH3)2 --физопропилацетат ----
CH3COOC3H7 ---- пропилацетатат
Физические свойства.
Сложные эфиры низших и средних гомологов спиртов и кислот - это бесцветные жидкости, легче воды, летучи. Низкомолекулярные эфиры растворимы в воде и органических растворителях. Многие из них обладают специфическим приятным запахом. Например:

|
| КАРЛ ВИЛЬГЕЛЬМ ШЕЕЛЕ (1742—1786) Шведский химик, |
- 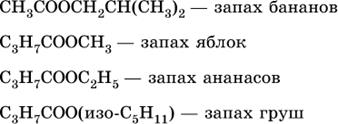 кислоты
кислоты
Способы получения:
Термин «эфир» впервые применил к синтетическим веществам Карл Вильгельм
Шееле (1742-1786) в 1782 г. Он указал, что исходными веществами для их получения служат карбоновые кислоты и спирты, а в качестве катализатора используется минеральная серная кислота. Прошло более 200 лет, а способ получения сложных эфиров в принципе не изменился.
1.Этерификация — взаимодействие кислот и спиртов в присутствии конц. серной кислоты, например получение этилацетата из уксусной кислоты и этилового спирта:
СН3COOH + C2H5OH ↔ СН3COOC2H5 + H2O
Реакции этерификации обратимы, сдвиг равновесия в сторону образования целевых продуктов достигается удалением одного из продуктов из реакционной смеси (чаще всего — отгонкой более летучих спирта, эфира, кислоты или воды)
2.Взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами, например получение этилацетата из уксусного ангидрида и этилового спирта:
(CH3CO)2O + 2 C2H5OH→2 СН3COOC2H5 + H2O
3.Взаимодействие солей кислот с алкилгалогенидами
CH3 COONa + C3H7 Cl →CH3 COO C3H7 + NaCl
4.Присоединение спиртов к алкенам в условиях кислотного катализа
(в присутствии кислот Льюиса):
RCOOH + R'CH=CHR'' → RCOOCHR'CH2R''
СН3COOH + C2H5CH=CHC3H7 →СН3COO CH (C2H5)CH2C3H7
Химические свойства.
1.Гидролиз сложных эфиров - реакция обратная этерификации. Протекает в кислой (обратимо) или щелочной (необратимо) среде.
В результате кислотного гидролиза бензилформиата образуются муравьиная кислота и бензиловый спирт.
HCOOCH2C6H5 + H2O ↔HCOOH +H OCH2C6H5
В результате щелочного гидролиза образуются спирт и соль карбоновой кислоты.
2.Восстановление. Сложные эфиры чаще восстанавливают в соответсвующие первичные спирты, реже в альдегиды или простые эфиры. Обычно для восстановления используют алюмогидрид лития:
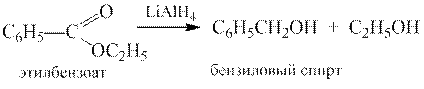
3. Образование амидов кислот под действием аммиака.
CH3COOC2H5+ HNH2 → CH3CO NH2 + HOC2H5
Амид уксусной кислоты этанол