| Название | Состав |
| Азурит (мин.) | 2CuC03.Cu(OH)2 |
| Алебастр (мин.) | CaS04. 0,5H20 |
| Ангидрит | CaS04 |
| Апатит (мин.) | 3Ca3(P04)2.Ca(F, Cl)2 |
| Арсин | AsH3 |
| Берлинская лазурь | Fe4[Fe(CN)6]3 |
| Бертолетова соль | КСlO3 |
| Боксит (мин.) | А1203.2Н20 |
| Болотная руда (мин.) | 2Fe203 • 3H20 |
| Бура | Na2B4O7.10H2O |
| Бурый железняк (мин.) | 2Fe203 • 3H20 |
| Веселящий газ | N20 |
| Гипс (мин.) | CaS04.2H20 |
| Гипс жженый | CaSO4.0,5H2O |
| Глауберова соль | Na2SO4.10H2O |
| Глинозем, корунд | A1203 |
| Диборан | B2H6 |
| Доломит | CaC03 • MgC03 |
| Жавелевая вода | КСlO3 (водн. р-р) |
| Железный колчедан (мин.), пирит | FeS2 |
| Известковая вода, гашеная известь | Са(ОН)2 (водн. р-р) |
| Известняк | СаС03 |
| Известь негашеная | СаО |
| Каломель | Hg2Cl2 |
| Каолин (мин.) | А1203 • 2Si02 • 2Н20 |
| Карборунд | SiC |
| Квасцы алюмокалиевые Хромовые | KA1(S04)2.12H20 KCr(S04)2.12H20 |
| Киноварь (мин.) | HgS |
| Корунд (мин.) | A1203 |
| Криолит | 3NaF. AlF3 |
| Кровяная соль желтая, красная | K4Fe(CN)6.3H20 K3Fe(CN)6 |
| Купорос железный медный цинковый | FeS04.7H20 CuS04.5H20 ZnS04.7H20 |
| Ляпис | Сплав 1 ч. AgN03 с 2 ч. KN03 |
| Магнезия белая | MgCO3 или 3MgC03 • Mg(OH)2 • 3H20 |
| Малахит | (CuOH)2CO3 |
| Мел, мрамор, известняк, кальцит | СаС03 |
| Нашатырный спирт | NH3. H2O(водн. р-р) |
| Нашатырь | NH4Cl |
| Олеум | Р-р S03 в H2S04 |
| Плавиковая кислота | HF |
| Поваренная соль (мин.) | NaCl |
| Поташ | K2C03 |
| Селитра аммиачная калиевая чилийская | NH4N03 KN03 NaN03 |
| Силан | SiH4 |
| Силикагель | Si02 |
| Сильвинит | NaCl. КCl |
| Сода кальцинированная питьевая каустическая(едкий натр), каустик | Na2C03 NaHC03 NaOH |
| Сулема | HgCl2 |
| Суперфосфат двойной Суперфосфат простой | Ca(H2P04)2.H20 Ca(H2P04)2.H20 в смеси с CaS04 |
| Тальк (мин.) | 3MgO . 4Si02 .H20 |
| Угарный газ | CO |
| «Царская водка» | Смесь 1 ч. конц. HN03 с 3 ч. конц. HCl |
| Фосфин | PH3 |
Номенклатура некоторых неорганических кислот и солей
| Название кислоты | Формула кислоты | Название средней соли |
| Азотистая | HNO2 | Нитрит |
| Азотная | HNO3 | Нитрат |
| Кремниевая | H2SiO3 | силикат |
| Марганцовая | HMnO4 | Перманганат |
| Марганцовистая | H2MnO4 | Манганат |
| Фосфорная (орто) | H3PO4 | Фосфат |
| Фосфористая (метафосфорная) | HPO3 | Фосфит (метафосфат) |
| Фосфорноватистая | H3PO2 | Гипофосфиты |
| Хлорноватистая | HClO | Гипохлорит |
| Хлористая | HClO2 | Хлорит |
| Хлорноватая | HClO3 | Хлорат |
| Хлорная | HClO 4 | Перхлорат |
| Соляная | HCl | Хлорид |
| Хромовая | H2CrO4 | Хромат |
| Хромистая | HCrO2 | Хромит |
| Двухромовая | H2Cr2O7 | Дихромат |
| Иодноватая | HIO3 | Иодаты |
| Иодная | H5IO6 | Периодаты |
Основные способы получения металлов
Металлургия – наука о методах и процессах производства металлов из руд.
1. Пирометаллургия – получение металлов из руд реакциями восстановления при высоких температурах (t0).
Из оксидов:
Восстановители: С, СО, Н2:
ZnO + C  Zn + CO
Zn + CO 
Алюминотермия:
Сr2О3 + 2Аl  2Сr + Аl2О3
2Сr + Аl2О3
Из сульфидов:
2ZnS + 3О2  2ZnO + 2SО2
2ZnO + 2SО2  ;
;
ZnO + C  Zn + CO
Zn + CO  .
.
2. Гидрометаллургия – получение металлов из растворов их солей:
CuO + H2SO4(р-р) = CuSO4 + H2O;
CuSO4 + Fe = FeSO4 + Cu.
3. Электрометаллургия – получение металлов, основанное на электролизе растворов и расплавов солей.
 2NaCl
2NaCl 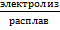 2Na0 +
2Na0 + 
Гидролиз веществ
Гидролиз – реакция обменного (гидролитического) разложения веществ водой.
Гидролизу подвергаются многие вещества:
карбиды: СаС2 + 2Н2О = Са(ОН)2 + С2Н2 
нитриды: Mg3N2 + 6Н2О = 3Mg(ОН)2 + 2NH3 
фосфиды: Ca3P2 + 6Н2О = 3Ca(ОН)2 + 2PH3 
галогениды: SiCl4 + 3Н2О = H2SiO3  + 4HCl
+ 4HCl 
углеводы: сахароза + вода = глюкоза + фруктоза
сложные эфиры, в т.ч. жиры:
сложный эфир + вода  карбоновая кислота + спирт
карбоновая кислота + спирт
Гидролиз соли – процесс обменного взаимодействия ионов соли с молекулами воды
Случаи гидролиза солей
| Кислота | Основание | |
| Сильный электролит | Слабый электролит | |
| Сильная | Гидролиз не идет. Среда нейтральная. Цвет индикаторов не изменяется | Гидролиз по катиону. Среда кислая. Красная окраска лакмуса |
| Слабая | Гидролиз по аниону. Среда щелочная. Малиновая окраска фенолфталеина | Гидролиз и по катиону, и по аниону. Среда может быть различной. Окраска индикаторов в соответствии с характером среды |
Сильные кислоты: HCl, Н2SО4, HNO3, HI, HClO4, HMnO4,HBr
Слабые кислоты: HF, H3PO4, H2SiO3, H2CO3, CH3COOH, H2S, HNO2, Н2SО3, органические кислоты
II. Органическая химия