В 1969 году Хугтон Миффлин опубликовал мою сотую книгу. (Если возник вопрос какую, то название этой книги – «Опус 100». Это что‑то вроде литературной автобиографии, с подборкой иллюстраций из ранних работ. – Примеч. авт.) «Бостон глоб» решил отметить это событие пространной статьей, следом за которой появилась еще одна статья в «Нью‑Йорк таймс». Кроме того, в день публикации Хугтон Миффлин притащил меня на вечеринку с коктейлем.
От всего этого у любого закружилась бы голова, и, чтобы не забыть о скромности, которая была всегда моей добродетелью, я постоянно напоминал себе случай, произошедший с моей матерью.
В начале 1950‑х годов мои родители наконец продали свой кондитерский магазин и ушли на пенсию. Естественно, отец не мог сидеть без дела, потому нанялся на работу с сокращенным рабочим днем, а мать стала учиться в вечерней школе.
Мать всегда тяжело переживала свое неумение писать по‑английски. Она могла делать это по‑русски и на идише, но ни на одном языке с латинским алфавитом. Умела читать по‑английски, но не знала, как писать. И потому мать стала брать уроки письма и скоро добилась впечатляющих успехов. Прошло совсем немного времени, и она написала мне письмо ясным почерком.
Однажды вечером ее остановил в вестибюле один из учителей вечерней школы с ее факультета и задал вопрос, который мы дома называем «этим старым добрым вопросом»: «Извините, миссис Азимов, но вы, случайно, не родственница Айзека Азимова?»
Моя мать немедленно ответила: «Да, в самом деле. Айзек Азимов – мой сын».
Учитель воскликнул: «О! Тогда неудивительно, почему вы так хорошо пишете!»
На это моя мать, вспомнив поговорку: яблоко от яблони недалеко падает, выпрямилась во все свои сорок футов и холодно произнесла: «Прошу прощения, сэр. Неудивительно, почему он – хороший писатель».
Напомнив себе об этом, дабы призвать свою скромность, я перейду к своему предмету, который начнется с той точки, на которой окончилась предыдущая глава.
В середине XIX столетия было обнаружено примерно тридцать элементов, и это начало внушать химикам тревогу. Каждое десятилетие число элементов возрастало: три было открыто в 1770‑х годах, пять – в 1780‑х, пять – в 1790‑х, четырнадцать – в 1800‑х, четыре – в 1810‑х, пять – в 1820‑х и так далее.
Возникала мысль: когда же это кончится? Ученые ценят простоту, а то, что казалось им простым, становилось все сложнее и сложнее. Требовался какой‑то новый порядок, в котором бы все снова стало простым. Для этого необходимо было найти некую закономерность в запутанном списке элементов, так чтобы можно было разбить элементы на отдельные «семейства». Это могло бы как‑то «расчистить джунгли».
В самом деле, если бы элементы были правильно организованы, стало бы ясно, сколько элементов существует всего и сколько, таким образом, элементов осталось неоткрытыми. В середине XIX столетия, однако, это казалось невыполнимой задачей.
В то время было известно, что атомы разных элементов имеют свои атомные веса. Так, если вес атома водорода (самого легкого из известных, как тогда, так и сейчас) равен 1, атом углерода, который массивнее в 12 раз, соответственно, должен иметь атомный вес 12, атом кислорода – 16 и так далее.
Тогда для начала можно попытаться организовать элементы в порядке атомных весов, чтобы определить, будут ли у них схожими какие‑нибудь семейства. Оказалось, что прямоугольная таблица может быть создана таким образом, чтобы схожие элементы распределялись столбцами или колонками (в зависимости от того, вертикально или горизонтально размещаются элементы). К сожалению, на самых первых таблицах объединялись друг с другом очень несхожие элементы, а в науке половинное решение – это не решение вообще.
Ясно, что главная проблема с организацией по атомным весам заключалась в том, что нельзя было определить, когда список завершится. Оказалось, что атомная масса углерода равна 12, азота – 14, а кислорода – 16. Как можно быть уверенным, что между ними не существует неоткрытых элементов с атомными массами 13 и 15? Кому нужна таблица, в которой зияют пустоты?
Конечно, можно возразить, что разница в 2 атомные массы очень мала, и вряд ли здесь есть промежуточный элемент, но уверенным в этом быть нельзя. Никель имеет атомную массу 58,7, а кобальт – 58,9. С такой разницей в атомной массе между углеродом и азотом могло бы уместиться девять элементов и еще девять между азотом и кислородом.
Это говорит о том, что полагаться только на атомные массы нельзя. Требуются еще какие‑либо свойства, и лучше всего, если эти свойства будут представлены целыми числами, чтобы, переходя, скажем, от 1 к 2 и от 2 к 3, мы знали, что между ними ничего нет.
Первые результаты такого подхода появились в 1852 году. Английский химик Эдуард Франкланд заметил, что в химических формулах, которые были созданы к этому времени, один атом одного элемента, похоже, всегда связан с фиксированным числом атомов других элементов.
Таким образом, атом водорода никогда не связан более чем с определенным числом атомов другого вещества. Это можно назвать степенью комбинирования единицы (или валентностью, от латинского слова, обозначающего «степень»). Атом кислорода может комбинироваться с двумя атомами водорода, атом азота с тремя атомами, а атом углерода – с четырьмя, так что кислород, азот и углерод имеют валентности в 2, 3 и 4 соответственно. Эти валентности работают очень четко. Таким образом, атом углерода (валентность 4) может комбинироваться с двумя атомами кислорода (2 + 2) или с одним атомом кислорода и двумя атомами водорода (2 + 1 + 1).
Концепция валентности не только отличается простотой, ясностью и явной полезностью, но и вводит целые числа, поскольку валентностей 1,5 или 2,32 – или какой‑либо в этом духе – не существует. (В действительности наука XX века дала новую концепцию, которая в самом деле ввела что‑то вроде дробных валентностей, но это не влияет на систему доказательств в данной главе. – Примеч. авт.)
В 1869 году русский химик Дмитрий Иванович Менделеев попытался организовать элементы согласно молекулярной массе и валентности. Результатом стала система, очень упрощенную и неполную версию которой я привожу в таблице 1 с атомными весами, округленными до одной десятой после запятой.
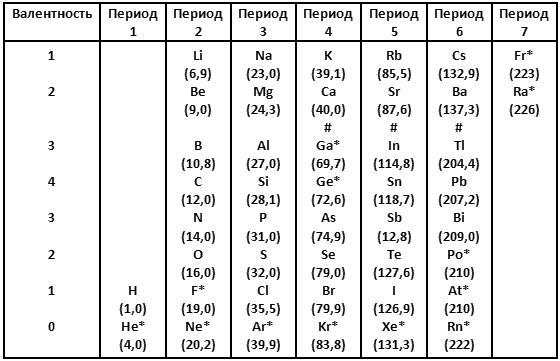
В таблице 1 я даю химические элементы так, чтобы сэкономить место; это не повлияет на систему доказательств и ни в коей мере не запутает, даже если вы не знаете, каким символом какой элемент обозначен. Когда мне придется упомянуть определенный элемент, я дам его полное название, вместе с символом.
Строки в таблице 1 содержат тесно связанные семейства элементов. К примеру, верхняя строка содержит литий (Li), натрий (Na), калий (К), рубидий (Rb), цезий (Cs) и франций (Fr), которые имеют одинаковые свойства. Эти элементы медленно плавятся, исключительно активны и при определенных условиях реагируют примерно одинаково. Более того, там, где различия существуют, они проявляют себя постоянным изменением вдоль строки. От лития к натрию, калию и так далее точка плавления вещества становится ниже, а активность его возрастает. Эти шесть элементов называют щелочными металлами.
Вторая строка содержит шесть щелочноземельных элементов, которые тоже имеют сходные свойства. И так далее на протяжении таблицы.
Заметим, что в периоде 5 теллур (Те) идет перед йодом (I), хотя теллур имеет большую атомную массу, а значит, должен находиться после йода, если бы классификация шла только по атомной массе.
Именно Менделееву принадлежит великая заслуга в том, что валентность (как и химические свойства в целом) стала учитываться в первую очередь по отношению к атомной массе. Для того чтобы поместить теллур и йод в надлежащее семейство с надлежащей валентностью, пришлось поменять порядок следования атомной массы. Более сложное знание атомной структуры, обретенное химиками в дальнейшем, доказало, что в этом отношении интуиция Менделеева оказалась абсолютно правильной.
Когда мы перемещаемся вниз по списку элементов согласно их молекулярной массе, периодически повторяется определенный набор свойств – по этой причине этот список, организованный так, что определенные наборы укладываются точно в строки или колонки, называются периодической таблицей.
В то время, когда Менделеев впервые выдвинул свою Периодическую систему, значительное число элементов, приведенных в таблице 1, еще не было открыто. Они указаны в таблице 1 звездочкой.
К примеру, шесть элементов в строке внизу – гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn) – не были известны в 1869 году. Об их существовании совершенно не представляли, и без них Периодическая система, казалось, имела законченный вид. Если идти последовательно сверху вниз в порядке атомных весов элементов, то изменение валентности в таблице 1 происходит (если исключить нижний ряд) по следующему порядку: 1, 1, 2, 3, 4, 3, 2, 1, 1, 2, 3, 4, 3, 2, 1, 1, 2 и так далее.
Однако, когда были открыты элементы в нижней строке, оказалось, что они не вступают в соединения с любыми другими элементами и, следовательно, имеют нулевую валентность. Таким образом, последовательность валентностей изменилась на следующую: 1, 0, 1, 2, 3, 4, 3, 2, 1, 0, 1, 2, 3, 4, 3, 2, 1, 0, 1, 2 и так далее.
Элементы нижней строки, имеющие схожие свойства и называемые инертными газами, или благородными газами, просто расширили таблицу, но не нарушили ее порядок. Наоборот, введение 0 в надлежащем месте сделало таблицу даже «элегантнее». Тот факт, что эта весьма неожиданно обнаруженная группа элементов столь превосходно вписалась в Периодическую систему, послужил дополнительным доказательством концепции Менделеева.
Для того чтобы сохранить аргон (Ar) на своем правильном месте в семействе инертных газов, его следует поставить перед калием (K), даже хотя это меняет порядок следования по молекулярным массам. И снова это повторилось в таблице с теллуром (Te) и йодом (I).
Заметим также, что в таблице 1 пять элементов с самыми большими атомными массами были неизвестны во времена Менделеева. Это полоний (Po), астат (At), радон (Rn), франций (Fr) и радий (Ra). Эти элементы были обнаружены в 1890‑х и в последующие годы; они являются радиоактивными. Все эти элементы относятся к нестабильным и присутствуют в земной коре в очень малых количествах. Поскольку все они располагаются в конце таблицы, их отсутствие не влияло на все остальные.
Затем возник фтор (F), который, строго говоря, не был хорошо изучен во времена Менделеева. Это очень своеобразный элемент. Фтор был обнаружен в различных соединениях, из которых его извлечь не удавалось. Свойства фтора были известны, но на основании свойств его соединений. Его связи в соединениях оказались столь тесны, что только в 1886 году химики смогли выделить фтор из соединений, чтобы исследовать этот элемент в чистом виде. Даже малоизученный, фтор присутствовал в таблице с самого начала (это напоминает ситуацию с глобусом, северные и южные поля которого были обозначены, даже несмотря на то, что полюсов достигнуть пока не удалось).
Было еще два элемента таблицы, галлий (Ga) и германий (Ge), с особой судьбой. После их обнаружения не пришлось искать, поместить ли их в последний ряд или последнюю строку, чтобы они не нарушали общий порядок. Хотя об их существовании не подозревалось, для них оставили «вакантное место» в середине таблицы.
Если бы это место не было оставлено и будущие галлий и германий были бы проигнорированы, то при попытке перечислить элементы в порядке атомных масс пришлось бы поместить мышьяк (As) справа от алюминия (Al) и селена (Se) и справа от кремния (Si) и т. д. Это бы совершенно разрушило организацию по семействам и валентности.
Менделеев отказался от этого, и это было одним из величайших его достижений. Он поместил мышьяк (As) справа от фосфора (P), а селен (Se) справа от серы (S), где их места соответствовали их свойствам. Поскольку это оставило два свободных места справа от алюминия (Al) и кремния (Si), Менделеев решил, что они предназначены для двух элементов, которые еще только предстояло открыть. Он назвал их эка‑алюминий и эка‑кремний, «эка» – санскритское слово, обозначающее единицу. Другими словами, отсутствующие элементы находились на одно место справа от алюминия и кремния соответственно.
Более того, Менделеев предсказал свойства отсутствовавших элементов с большой точностью – он счел, что галлий (Ga) будет иметь свойства, промежуточные между алюминием (Al) и индием (In), а германий (Ge) – промежуточные между кремнием (Si) и цинком (Sn).
Поначалу большинство химиков мира снисходительно улыбались на «этого сумасшедшего русского», но в 1875 году был открыт галлий, а в 1886 году германий, и предсказания Менделеева сбылись во всех отношениях. Химики перестали смеяться.
Значит ли это, что описываемая нами система совершенна?
Увы, нет. Версия Периодической системы, что приведена в таблице 1, содержит лишь сорок четыре элемента, а их намного больше. Такие хорошо известные элементы, как золото, серебро, медь, железо, платина, марганец и вольфрам (все прекрасно изученные во времена Менделеева), не имели своего места в Периодической системе – в той форме, в которой она представлена в таблице 1.
Следует ли после этого отбросить систему, или же можно найти место для дополнительных элементов?
Обратите внимание, что три ячейки таблицы я пометил знаком #. Между кальцием (Ca) и галлием (Ga) разница в атомных массах составляет 29,7; между стронцием (Sr) и индием (In) 27,2; а между барием (Ba) и таллием (Tl) целых 67,1. Эти разницы немного больше, чем где‑либо в Периодической системе. Если не обращать внимания на эти три интервала, то средняя разница в атомных массах от элемента к элементу во всей остальной таблице составит только 2,5.
Если мы примем 2,5 за среднюю атомную массу между соседними элементами таблицы, то останется пространство для двенадцати элементов между кальцием (Ca) и галлием (Ga), для одиннадцати элементов между стронцием (Sr) и индием (In) и для не менее чем двадцати семи между барием (Ba) и таллием (Tl).
Возможно ли это?
Да, возможно, если мы решим, что периоды в Периодической системе могут иметь не одинаковую длину (как считали некоторые поначалу), а увеличиваться по направлению к концу таблицы.
К примеру, во времена Менделеева в первом периоде имелся только один элемент, водород (H), тогда как во втором и третьем периодах было по семь элементов. Через одно поколение, когда были открыты инертные газы, оказалось, что в первом периоде находятся уже два элемента, а во втором и третьем периодах по восемь (с тех пор здесь изменений не было). Тогда почему в следующих периодах нельзя увеличить число элементов до двадцати, тридцати и даже больше?
В самом деле, во времена Менделеева было известно не менее девяти элементов с атомными массами, которые были между атомными массами кальция (Ca) и галлия (Ga); эти элементы словно заполняли большой зазор между этими массами. Аналогично девять элементов заполняли зазор между стронцием (Sr) и индием (In).
Проблема состоит в том, что валентность уже в отличие от положения с таблицей 1 не является первостепенным и определяющим фактором в этом зазоре. Элементы этого зазора расположены между элементом с валентностью 2 и элементом с валентностью 3 – от кальция (Ca) до галлия (Ga) в первом случае и от стронция (Sr) до индия (In) во втором, и, поскольку они осуществляют что‑то вроде перехода от 2 до 3, их можно назвать транзитными элементами. В этой главе я буду называть элементы в таблице 1 валентными элементами.
Размещая в таблице транзитные элементы, мы можем частично руководствоваться атомными весами, частично – менее четко обозначенными валентными свойствами и частично другими химическими свойствами. Делая это, мы можем взять восемнадцать известных элементов первых двух промежутков (которые были известны к 1869 году) и выстроить их так, как показано в таблице 2.
К такому расположению трудно придраться. К примеру, ясно, что серебро (Ag) должно быть справа от меди (Cu) и что кадмий (Cd) должен быть справа от цинка (Zn), если исходить в первую очередь из основных химических свойств. Аналогично и с другими элементами. Только в указанном порядке свойства элементов соответствуют свойствам своих соседей, и у них даже атомные массы расположены по порядку, за исключением кобальта (Со) и никеля (Ni), у которых для того, чтобы сохранить последовательность химических свойств, атомные массы необходимо поменять местами. Но и в этом случае атомные массы находятся столь близко друг к другу, что подобная перестановка особенно картины не нарушает (это третий – и последний – случай перестановки в Периодической системе элементов по их атомным массам).
Таблица 2
Переходные элементы

Но в нашей таблице 2, в которой представлены четвертый и пятый периоды, есть два незанятых места. Одно из них оставлено слева от иттрия (Y), а другое – справа от марганца (Mn). Менделеев предсказал, что слева от иттрия (Y) должен располагаться новый элемент (уже третий из предсказанных им). Он назвал этот элемент эка‑бор, поскольку в первой версии таблицы он оставил пустое место справа от бора (В). Менделеев указал и свойства будущего элемента.
Эта ячейка была заполнена в 1879 году, когда был обнаружен скандий (см. главу 11). Его символ Sc; его атомная масса очень удачно вписалась между кальцием (Ca) и титаном (Ti).
Ячейку справа от марганца (Mn) оказалось заполнить не столь легко. Элемент, который подошел сюда, был обнаружен только в 1937 году. Его назвали технецием (Tc, атомная масса 99). В результате промежуток в атомных массах транзитных элементов казался практически заполненным (если брать в расчет по десять элементов подряд в четвертом и пятом периодах, считая и пустые ячейки). Атомные массы в среднем разнились на 2,6, в то время как в среднем разница для валентных элементов составляла 2,5.
Но можно ли было, руководствуясь разницей в атомных массах (и во вторую очередь валентностью), с уверенностью сказать, что в каждой из двух серий транзитных элементов по одиннадцать элементов, и только? Может быть здесь двенадцатый элемент? Предположим, к примеру, что между с и d в каждой из двух серий отсутствует по элементу. Если такого элемента нет между с и d только в одной серии, то по элементу другой серии мы легко определим пустое место (к примеру, пустое место слева от иттрия в таблице 1). Но если в обеих сериях мы не знаем элементы, то их существование мы не сможем даже предположить (как произошло в случае с инертными газами, поскольку все эти элементы были неизвестны и об их существовании не подозревали. Как только один из них был открыт, сразу возникли пустующие ячейки в таблице; неизвестные элементы начали искать и вскоре обнаружили).
В пользу того, что правильным числом для транзитных элементов является 10, служит тот факт, что общее количество элементов в периодах четвертом и пятом, валентных и переходных, равно 18, и это выявляет интересную закономерность. Она заключается в следующем: общее число элементов в первом периоде равно 2 × 12 = 2; общее число в периодах втором и третьем равно 2 × 22 = 8; и общее число в периодах 4 и 5 равно 2 × 32 = 18.
Эта зависимость выглядит очень заманчивой, и у людей вроде меня, с любовью к числам, сразу возникает вопрос: но почему элементы столь точно подчиняются этой закономерности? В XIX столетии не было теории, которая бы объяснила ее, и потому это, возможно, просто совпадение, которое могло привести к неверным выводам.
По этой причине химики не могли быть уверены, и Периодическая система, хотя и считалась весьма удобной, оставалась под сомнением.
Но перейдем к третьей серии транзитных элементов – тех, которые должны были послужить мостом между элементами с особенно значительными атомными весами – барием (Ba) и таллием (Tl). Во времена Менделеева здесь было известно одиннадцать элементов. Если мы попытаемся связать их с двумя другими сериями транзитных элементов по схеме от а до j, то получим таблицу 3.
Таблица 3
Переходные элементы

Элементы, показанные в таблице 3, несомненно, согласуются с элементами из таблицы 2. Таким образом, золото (Au) ясно стоит в своей позиции i справа от меди (Cu) и серебра (Ag) – и остальные приведенные в таблице элементы стоят на соответствующих местах.
Однако здесь есть две пустые ячейки. В позиции b должен присутствовать какой‑то элемент справа от циркония (Zr) – и в 1923 году этот элемент был открыт. Его назвали гафнием (Hf, атомная масса 178,5), он был найден в циркониевой руде. Элемент прекрасно вписался в свое место – пожалуй, даже слишком прекрасно. Открытие гафния заняло много времени не потому, что элемент был очень редким, а потому, что он очень походил на цирконий по своим свойствам, так что было трудно отделить его от пятидесяти более распространенных близнецов.
Пустое место в ячейке e было заполнено в 1925 году с открытием рения (Re, атомная масса 186,2).
В третьей транзитной серии не было открыто ни одного элемента, который бы показывал на существование неизвестных ранее пустот в первой или второй транзитной серии. Это свидетельствовало в пользу предположения, что в каждой из этих первых двух серий существует по десять элементов.
Но даже после открытия гафния (Hf) можно заметить, что существует внушительный пробел в атомных массах между атомными массами гафния и лантана (La) – пробел в 39,6. Этот пробел существует между элементами a и b шестого периода – но столь же большого пробела нет в соответствующих ячейках четвертого и пятого периодов. В пробеле шестого периода есть место для целого ряда элементов.
Я раньше говорил, что во времена Менделеева было известно одиннадцать элементов с атомными весами, лежащими между атомными весами бария (Ba) и таллия (Tl). Таблица 3 имеет только восемь из них. Что с тремя другими?
Эти три других имеют атомные веса, которые действительно попадают в возникший после открытия гафния зазор между лантаном (La) и гафнием (Hf), и это церий (Ce), эрбий (Er) и тербий (Tb).
Это три редкоземельных элемента, о которых я говорил в предыдущей главе. Два других были известны во времена Менделеева: лантан (La) и иттрий (Y) – и вскоре был открыт еще один, скандий (Sc). Скандий, лантан и иттрий, однако, соответствуют строке a в четвертом, пятом и шестом периодах и являются обычными переходными элементами. Только церий, эрбий и тербий являются элементами, которые должны быть помещены в этот промежуток в шестом периоде. К 1907 году было определено еще десять редкоземельных элементов с атомными весами, которые позволили расположить эти элементы в этом интервале. Список всех тринадцати представлен в таблице 4.
Таблица 4
Редкоземельные элементы

Но сколько еще может быть элементов?
Вернемся обратно к игре в числа, которую я ввел несколько раньше. Та же самая система, которая объясняет числа 2, 8, 8, 18, 18 для первых пяти периодов, должна дать общее количество элементов в шестом периоде: 2 × 42 = 32. Поскольку валентные элементы и транзитные элементы вместе в шестом периоде составляют 18, число редкоземельных элементов для заполнения интервала должно составить 14, чтобы общее количество было равно 32.
У нас есть 13 элементов, где нам найти 14‑й?
Разница атомных масс неодима (Nd) и самария (Sm) составляет 6,2, более чем в два раза превышая обычное значение. Возможно, 14‑й элемент находится именно в этом промежутке. Однако разница атомных масс европия (Eu) и гадолиния (Gd) равняется 5,3, а тулия (Tm) и иттербия (Yb) – 4,1. Может быть и такое, что в промежутках отсутствуют три элемента, по элементу в каждом. Кто знает, может, число таких элементов даже больше, поскольку не может быть привязанности лишь к численным соотношениям в отсутствие физических свидетельств, которые объяснили бы их правильность.
Короче говоря, через сорок лет после того, как Менделеев представил Периодическую систему элементов, она остается неполной. Несмотря на ее невероятный триумф системы и точность, с которой она решала почти все вставшие перед ней проблемы, химики не могли быть уверены, что она правильна во всех отношениях. В частности, они не знали, верно ли она отображает редкоземельные элементы.
По этой причине, а также в силу менее важных обстоятельств химики усердно изучали все редкоземельные минералы, чтобы определить, сколько элементов они могут идентифицировать с абсолютной уверенностью. Если бы удалось найти что‑то новое, это могло бы сокрушить всю Периодическую систему.
Но они ничего не нашли. Вместо этого в 1914 году Периодическая система получила наконец законченную форму – и это произошло благодаря совершенно неожиданному ходу событий, которые, казалось, не имели с химией ничего общего. Мы проследим за этими событиями в следующей главе.
Глава 13