М. А. Богородская
ПОСОБИЕ
ПО ОРГАНИЧЕСКОЙ ХИМИИ
Для химических классов
Учебного комплекса РХТУ им. Д.И.Менделеева
Москва 2002
Названия некоторых насыщенных углеводородов (алканов)
И одновалентных радикалов.
| № п/п | АЛКАНЫ | АЛКИЛЫ | |||
| Формула молекулы | Сокращённая структурная формула | Название | Сокращённая структурная формула | Название | |
| CH4 | CH4 | метан | CH3− | метил | |
| C2H6 | CH3CH3 | этан | CH3CH2− | этил | |
| C3H8 | CH3CH2CH3 | пропан | CH3CH2CH2− | пропил | |
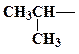
| изопропил | ||||
| C4H10 | CH3 CH2CH2CH3 | бутан | CH3CH2CH2CH2− | бутил | |
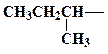
| втор -бутил | ||||
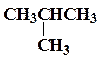
| изобутан | 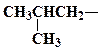
| изобутил | ||
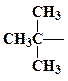
| трет- бутил | ||||
| C5H12 | CH3(CH2)3CH3 | пентан | CH3(CH2)3CH2− | пентил (амил) | |
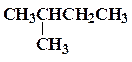
| изопентан | 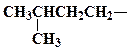
| изопентил (изоамил) | ||
| C6H14 | CH3(CH2)4CH3 | гексан | CH3(CH2)4CH2− | гексил |
Названия некоторых непредельных радикалов
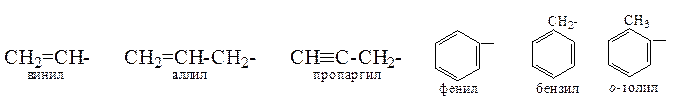
Классификация органических соединений, порядок уменьшения старшинства и обозначение некоторых функциональных групп при составлении названия по систематической номенклатуре.
| № п/п | Класс соединений | Общая формула | Функцио- нальная группа | Префикс | Суффикс, окончание |
| Карбоновые кислоты | 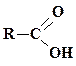
| 
| карбокси- | -овая кислота | |
| Альдегиды | 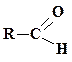
| 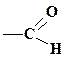
| оксо- | -аль | |
| Кетоны | 
| 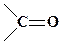
| оксо- | -он-№ | |
| Спирты | R-OH | -OH | гидрокси | -ол-№ | |
| Амины | R-NH2 | -NH2 | амино | -амин | |
| Алкены | CnH2n | 
| - | -ен-№ | |
| Алкины | CnH2n | -CºC- | - | -ин-№ | |
| Галогено- производные | R-X | F, Cl, Br, I | №-фтор, хлор, бром, иод | ||
| Нитро- соединения | R-NO2 | -NO2 | нитро- | ||
| Алканы | CnH2n+2 | -R | алкил (метил, этил и т.д.) | -ан |
Тривиальные названия некоторых соединений
CH2=CH2 - этилен (этен)
CH2=CH-CH3 - пропилен (пропен)
CHºCH - ацетилен (этин)
CH2=O - формальдегид, муравьиный альдегид (метаналь)
CH3CH=O - ацетальдегид, уксусный альдегид (этаналь)
HCOOH - муравьиная кислота (метановая кислота)
CH3COOH - уксусная кислота (этановая кислота)
CH2=CHCOOH - акриловая кислота (пропеновая кислота)
CHºC-CH2OH - пропаргиловый спирт
АЛКАНЫC n H2 n +2
Получение
1. Реакция Вюрца. Удобна для получения симметричных алканов. RX –обычно первичный или (хуже) вторичный галогеналкан. Третичные алкилгалогениды в реакцию не вступают.
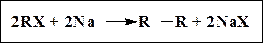
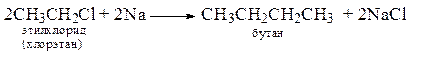
2. Анодный синтез Кольбе
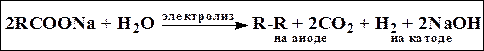
 2RCOONa + 2H2O электролиз R-R + 2CO2 + H2 + 2NaOH
2RCOONa + 2H2O электролиз R-R + 2CO2 + H2 + 2NaOH
144424443 144424443
на аноде на катоде
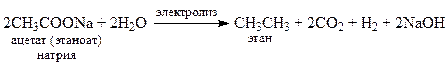
3. Термическое разложение натриевых солей карбоновых кислот (декарбокси-лирование)
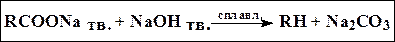
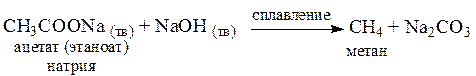
6. Гидрирование ненасыщенных углеводородов
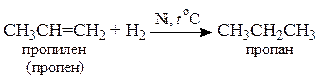
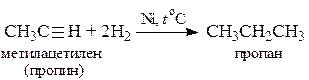
7. Получение метана
а). Прямой синтез
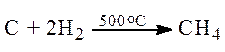
б). Восстановление оксидов углерода СО и СО2.
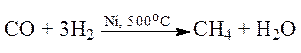
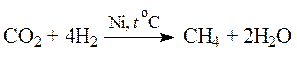
в). Из карбида алюминия.
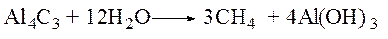
8. В промышленности – из природного или крекинг-газа газа
Химические свойства
1. Галогенирование (при освещении или t oC > 300 oC)
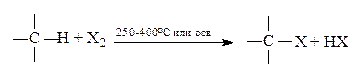
Реакционная способность галогенов: Cl2>>Br2 (I2 – не реагирует)
Реакционная способность атомов водорода убывает в ряду:
третичный > вторичный > первичный > СН3-Н
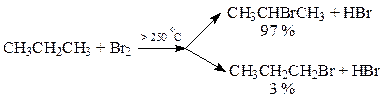
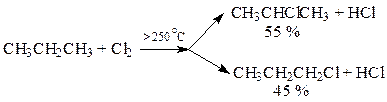
2. Нитрование (реакция Коновалова)
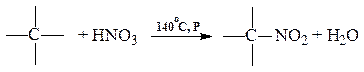

3. Окисление
а). Мягкое каталитическое окисление бутана – способ получения уксусной кислоты
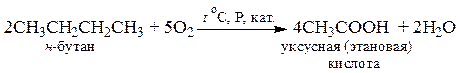
б) При мягком окислении метана кислородом воздуха в присутствии катализаторов, могут быть получены метиловый спирт, формальдегид, муравьиная кислота
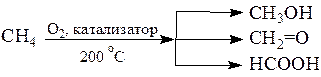
в). Горение

CH4 + 2O2 → CO2 + 2H2O
4. Изомеризация
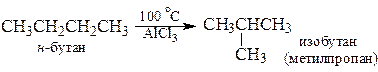
5. Крекинг. При крекинге высших алканов образуются алкены-1 и алканы с меньшей молекулярной массой.
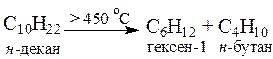
Крекинг (пиролиз) метана
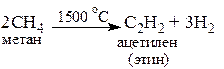
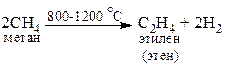
6) Дегидрирование и риформинг
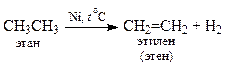
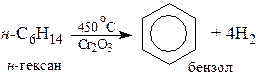
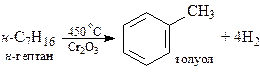
Анализ, качественные реакции
Неизвестное соединение относят к классу алканов на основании отрицательных результатов анализа. При качественном анализе алканы дают отрицательную реакцию на все элементы кроме углерода и водорода. Количественное сжигание показывает отсутствие кислорода. Вместе с определением молекулярной массы дает молекулярную формулу C n H2 n +2.
Алканы нерастворимы не только в воде, но также в разбавленных кислотах, щелочах, в концентрированной серной кислоте. Алканы не реагируют с большинством химических реагентов.
ЦИКЛОАЛКАНЫC n H2 n
Получение
1. Дегалогенирование дигалогеналканов
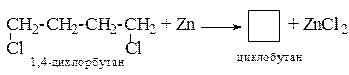
2. Гидрирование аренов
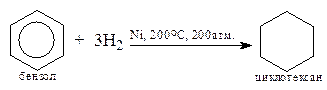
3. Пиролиз солей дикарбоновых кислот
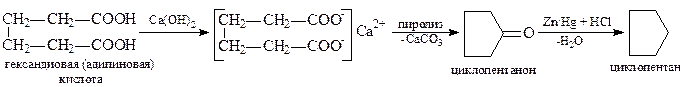
Химические свойства
За исключением небольшого числа очень важных и интересных реакций циклические алифатические углеводороды претерпевают те же превращения, что и их ациклические аналоги (реакции SR).
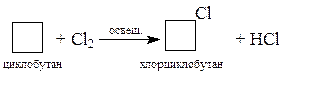
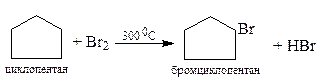
Шестичленные циклы легко вступают в реакцию дегидрирования с получением ароматических углеводородов.
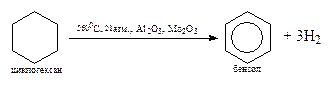
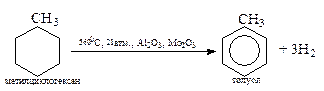
Малые циклы (циклопропан и циклобутан) вступают в некоторые реакции присоединения, при которых происходит раскрытие цикла. Циклобутан вступает в реакцию раскрытия цикла только с водородом
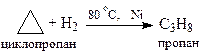
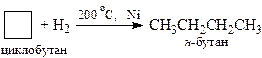
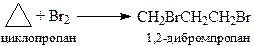
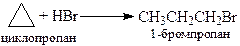
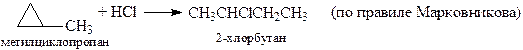
АЛКЕНЫ(олефины) C n H2 n
Получение
1. В промышленности – при крекинге нефти и дегидрировании
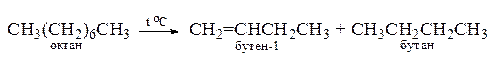
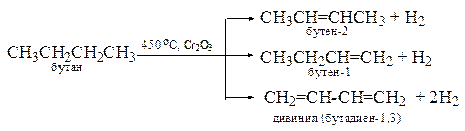
2. Дегидрогалогенирование алкилгалогенидов. (Отщепление происходит по правилу Зайцева)
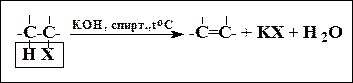
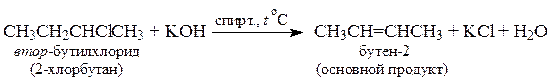
Реакционная способность алкилгалогенидов в реакции отщепления убывает в ряду:
третичный > вторичный > первичный
3. Дегидратация спиртов (t oC, H2SO4, H3PO4, Al2O3)
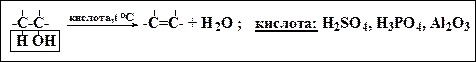
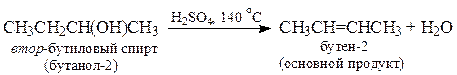
Легкость дегидратации спиртов:
третичный > вторичный > первичный
4. Дегалогенирование вицинальных дигалогенидов (Zn или Mg)
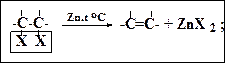
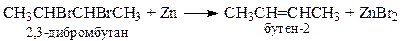
5. Гидрирование алкинов
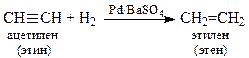
6. Этилен
Основной метод получения – пиролиз жидких дистиллятов нефти или низших парафиновых углеводородов. Разработан метод получения этилена из метана. Реакцию проводят на оксидах Mn, Tl, Cd или Pb при 500-900оС в присутствии кислорода.
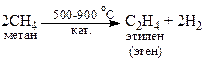
Наиболее чистый этилен получают дегидратацией этанол а при 450оС над Al2O3.
Химические свойства
1. Присоединение водорода, гидрирование ((Ni/140 0C, Pd/25 0C)
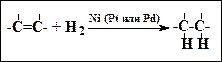
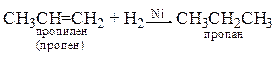
2. Присоединение галогенов (t комн oC., в растворе, например, CCl4)
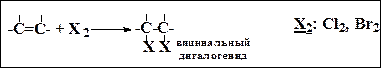
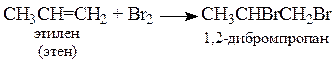
3. Присоединение галогеноводородов (t комн oC., в растворе)
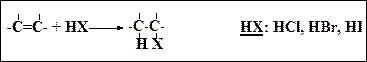
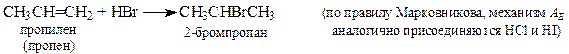
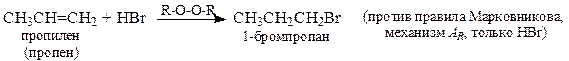
4. Присоединение воды (гидратация)
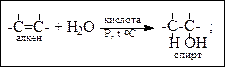
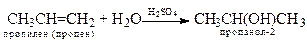
5. Гидроксилирование (реакция Вагнера, образование гликолей) в нейтральной или слабощелочной среде
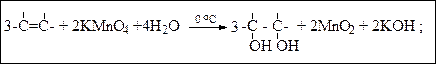
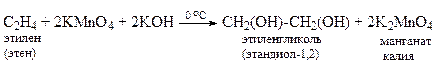
6. Деструктивное окисление алкенов. Жесткое окисление происходит с разрывом углеродной цепи с максимальным окислением атомов углерода в месте разрыва (с образование карбоновых кислот, кетонов и СО2)
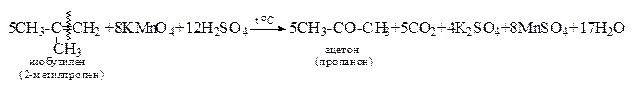
7. Озонолиз (используется для установления структуры)
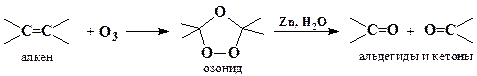
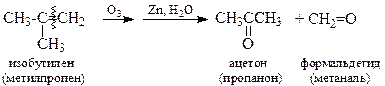
8. В присутствии катализатора – мелкодисперсного серебра или оксида серебра Ag2O – этилен окисляется кислородом воздуха, образуя окись этилена, которая легко реагирует с водой, давая этандиол-1,2
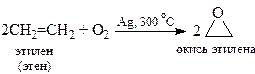
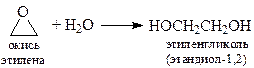
Окисление этилена в присутствии солей палладия дает ацетальдегид
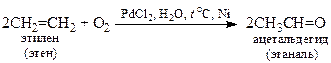
9. Аллильное замещение (по sp 3-углероду, SR)

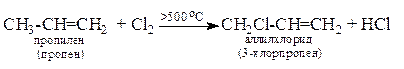
10. Реакции полимеризации.
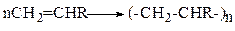
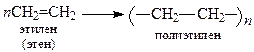
| 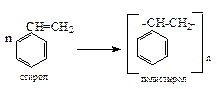
|