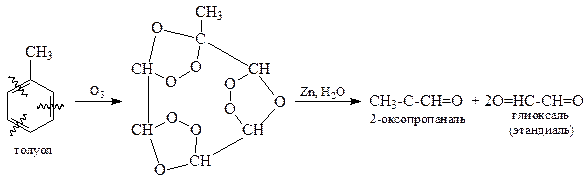Обесцвечивают раствор брома в CCl4 (или бромную воду).
Обесцвечивают холодный разбавленный (нейтральный или щелочной) раствор перманганата калия. (Аналогичные реакции дают алкины).
Алкены растворимы в холодной концентрированной серной кислоте (проба положительна для всех кислодородсодержащих соединений).
Озонолиз позволяет установить структуру алкенов.
АЛКАДИЕНЫC n H2 n -2
Получение
1. Дегидрирование бутан-бутеновой (изопентан-изопентеновой) фракциипри переработке нефти.
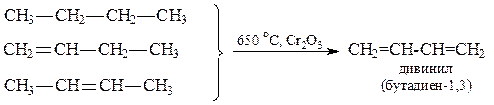
2. Реакция Лебедева
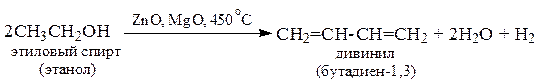
3. Из двухатомных спиртов.
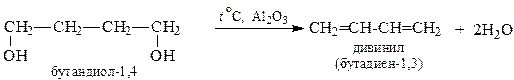
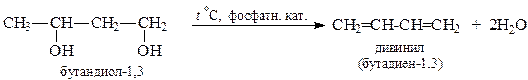
Химические свойства
Изолированные двойные связи мало влияют друг на друга, т.е. каждая реагирует так, как если бы она была единственной связью в молекуле.
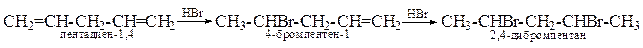
Особенности сопряжённых диенов – наряду с 1,2-присоединением вступают в реакцию 1,4-присоединения с перемещением двойной связи в центр сопряженной системы
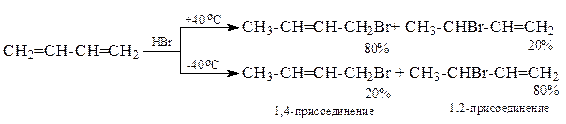
Полимеризация
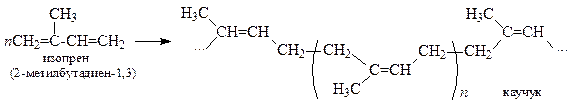
| Полимеризация протекает как 1,4‑присоединение с получением стереорегулярной «голова к хвосту» цис‑конфигурации. При нагревании с серой происходит вулканизация каучука и образование резины Резина | 
|
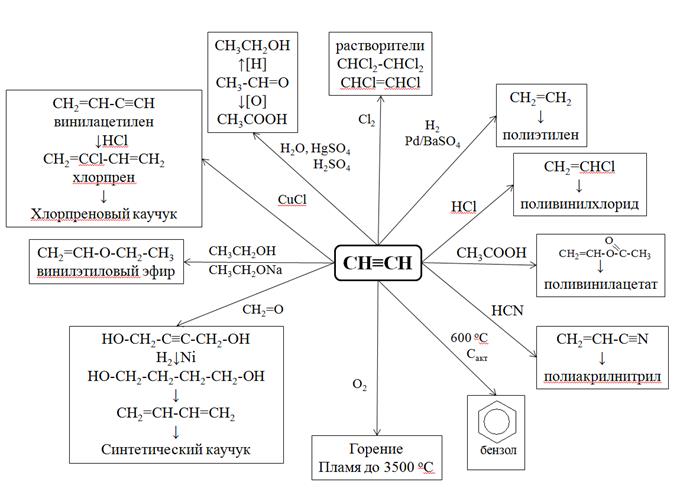
АЛКИНЫ(ацетиленовые углеводороды) C n H2 n -2
Получение
1. Крекинг (пиролиз) метана
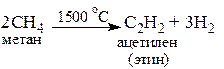
2. Гидролиз карбидов (CaC2, SrC2, BaC2)
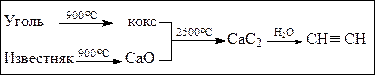
| CaC2 + 2H2O → C2H2 + Ca(OH)2 |
3. Из дигалогенидов (геминальных и вицинальных).
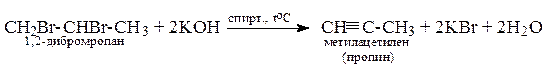
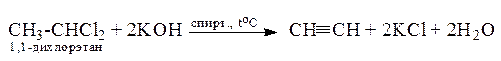
4. Дегалогенирование тетрагалогенидов
-CX2-CX2- + 2Zn ® -CºC- + 2ZnX2
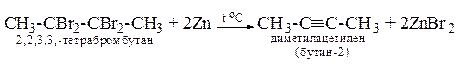
5. Алкилирование ацетиленидов. Реакция ацетиленидов натрия с алкилгалогенидами (обычно с первичными, так как у вторичных и третичных преобладает реакция отщепления).
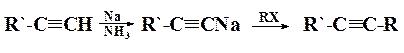
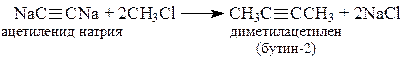
Химические свойства
Реакции присоединения (обычно механизм АЕ)
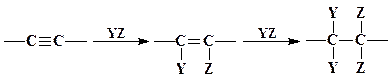
1. Гидрирование
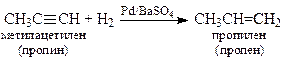
2. Галогенирование (Cl2, Br2) Реакция идет медленнее, чем с алкенами
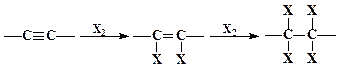
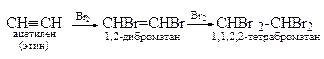
3. Гидрогалогенирование (HCl, HBr, HI).
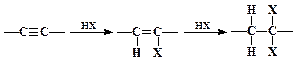
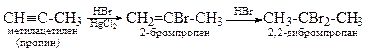
4. Гидратация (Реакция Кучерова)
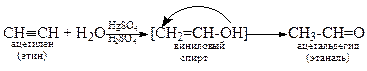
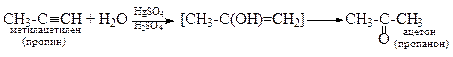
5. Димеризация
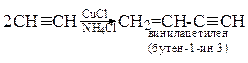
6. Тримеризация (реакция Зелинского)
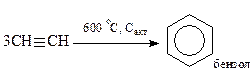
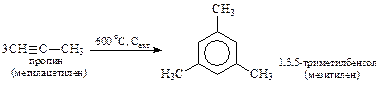
Кислотные свойства
7. Взаимодействие с солями тяжелых металлов
-СºСН + Me+ ® -CºC-Me + H+ Me+: Ag+, Cu+
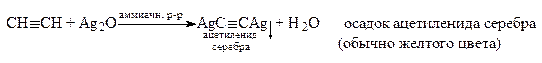
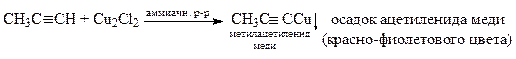
Ацетилениды серебра и меди устойчивы к действию воды и разрушаются с выделением ацетилена только при действии сильных кислот.
AgCºCAg + 2HCl ® HCºCH + 2AgCl
Реакции окисления.
8. Жесткое окисление (перманганатом в кислой среде).
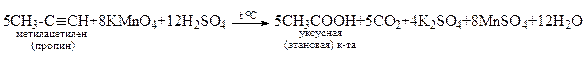
9. Мягкое окисление. При осторожном действии разбавленного раствора перманганата (0 оС) ацетилен можно окислить до щавелевой кислоты (точнее оксалата калия)
3CHºCH + 8KMnO4 ® 3KOOC-COOK + 8MnO2¯ + 2KOH + 2H2O
оксалат калия
Анализ, качественные реакции
Алкины дают практически те же характерные реакции, что и алкены: обесцвечивают раствор брома в четыреххлористом углероде, обесцвечивают холодный разбавленный раствор перманганата калия.
Не окисляются хромовым ангидридом (CrO3).
Алкины с концевой тройной связью можно отличить превращением их в нерастворимые ацетилениды серебра и меди (I).
При озонолизе образуются карбоновые кислоты, а не альдегиды и кетоны, как у алкенов.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫC n H2 n -6
Получение
1. Из каменного угля. Наиболее старый метод получения – выделение из пирогазовых продуктов коксования каменных углей. При коксовании 1т угля можно получить около 55кг каменноугольной смолы. Из этого количества смолы можно выделить 900г бензола, 225г толуола и 2300г нафталина.
2. Каталитический риформинг (циклизация и дегидрирование).
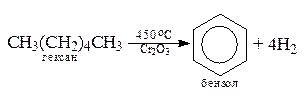
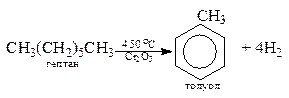
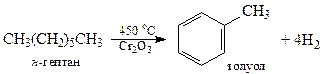
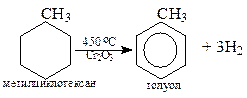
3. Дегидрирование циклоалканов
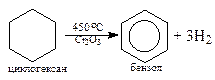
4. Алкилирование по Фриделю-Крафтсу
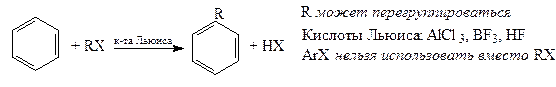
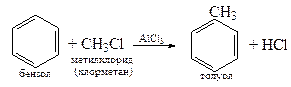
5. Алкилирование алкеном
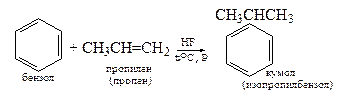
6. Декарбоксилирование бензоата натрия
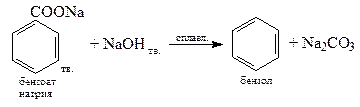
7. Тримеризация (реакция Зелинского)
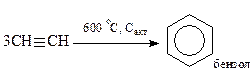
Химические свойства
Реакции присоединение (не характерны)
1. Гидрирование
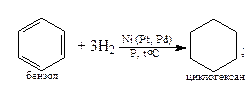
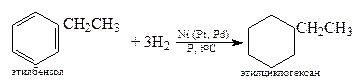
2. Присоединение галогенов (Cl2, Br2)
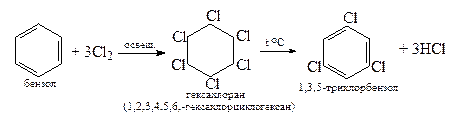
Реакции замещения (характерные реакции аренов)
3. Замещение в кольце, SE Ar (в ароматическом ряду.)
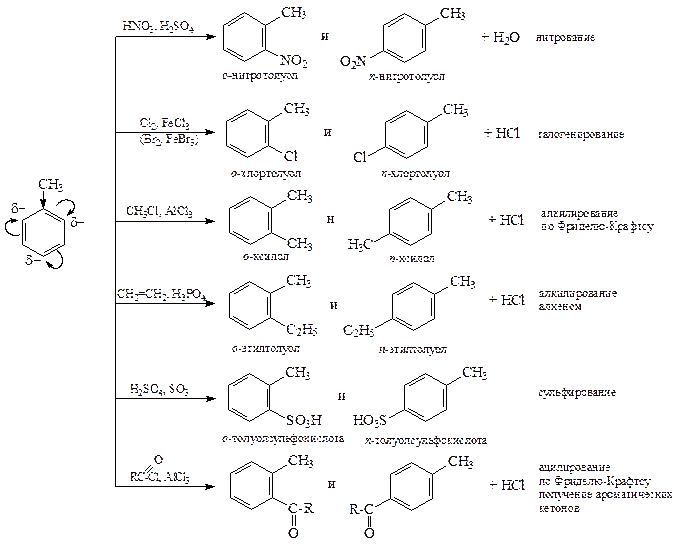
Алкилирование и ацилирование по Фриделю-Крафтсу и алкилирование алкеном при наличии заместителей II-го рода не происходит.
Влияние групп на SE в ароматическом ряду
а) Заместителя I-рода, активирующие, орто-, пара-ориентанты
Сильно активирующие: ‒ NH2, (-NHR, -NR2), -OH
Умеренно активирующие: ‒ OCH3 (-OR)
Слабо активирующие: ‒CH3 (‒R)
б) Заместители II-го рода, дезактивирующие, мета-ориентанты
‒NO2, ‒CºN, ‒SO3H, ‒CH=O, ‒COOH, ‒CO-R
в) Дезактивирующие, орто-, пара-ориентанты
‒Cl, ‒Br, ‒I
4. Замещение в боковую цепь ( SR)
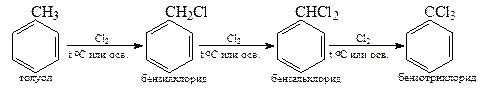
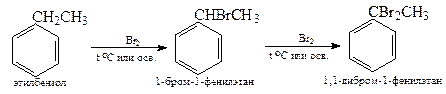
Реакции окисления
5. Окисление алкилбензолов. Бензол относительно устойчив к окислению, но гомологи окисляются легко. Боковая цепь окисляется так, что у кольца остается только карбоксильная группа, указывающая на исходное положение боковой цепи. Обычно арены окисляют горячим нейтральным раствором KMnO4, при этом получаются растворимые в воде соли ароматических кислот.
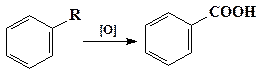
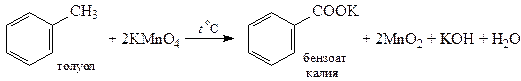
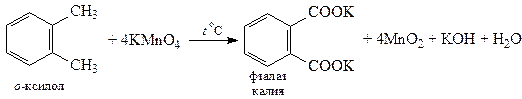
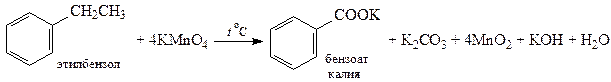
При окислении горячим кислым раствором KMnO4 получаются ароматические кислоты, нерастворимые в воде
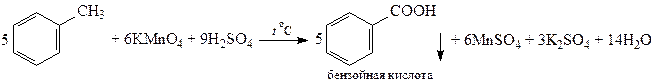
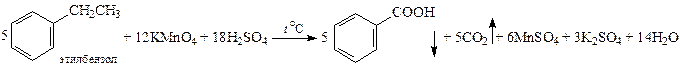
Озонолиз