С. В. Мараховская
КАЧЕСТВО ВОДЫ
(ГИГИЕНИЧЕСКАЯ ОЦЕНКА,
МЕТОДЫУЛУЧШЕНИЯ)
Методические рекомендации
 |
Минск 2005
УДК 614.777 (075.8)
ББК 51.21 я 73
М 25
Утверждено Научно-методическим советом университета
в качестве методических рекомендаций 15.06.2005 г., протокол № 9
Автор канд. мед. наук С. В. Мараховская
Рецензенты: доц. каф. гигиены и медицинской экологии Белорусской медицинской академии последипломного образования, канд. мед. наук С. П. Бобровских; доц. каф. гигиены труда, канд. мед. наук И. П. Семенов
Мараховская, С. В.
М 25 Качество воды (гигиеническая оценка, методы улучшения): метод. рекомендации /
С. В. Мараховская. – Мн.: БГМУ, 2005. – 24 с.
Приводятся нормативы принятого и ныне действующего в нашей республике СаНПиН (1999 г.), изучение которых помогает студентам понять важность проблемы обеспечения населения качественной водой.
Рассматриваются методы улучшения качества воды и методики определения соответствия качества воды действующему СаНПиНу.
Предназначается студентам 3-го курса всех факультетов.
УДК 614.777 (075.8)
ББК 51.21 я 73
© Оформление. Белорусский государственный
медицинский университет, 2005

Общее время занятий: 4 учебных часа
Мотивационная характеристика темы. На сегодняшний день питьевая вода является одним из основных источников переноса различных заболеваний. Отсюда вытекает важнейшая задача гигиены водоснабжения — обеспечение населения доброкачественной водой в достаточном количестве. По данным ВОЗ, ежегодно в мире из-за низкого качества воды умирает около 5 млн. человек. Поэтому врачи, независимо от профиля, должны знать, какие заболевания могут передаваться через воду и вода какого качества необходима для удовлетворения физиологических нужд организма.
Цель занятия: студенты должны ознакомиться с требованиями к питьевой воде и научиться оценивать данные анализов воды как возможного источника заболеваний, вызванных бактериями, вирусами, простейшими или паразитарными агентами, а также изменением химического состава различных водоисточников в результате загрязнений промышленными и сельскохозяйственными отходами.
Задачи занятия:
1. Ознакомиться с требованиями к воде централизованного и местного водоснабжения.
2. Закрепить знание заболеваний, источником которых служила вода, содержащая патогенные бактерии, вирусы, простейшие и паразитарные агенты.
3. Обратить внимание на заболевания, возникающие при употреблении воды, содержащей различные химические вещества в количествах, превышающих допустимые.
4. Уметь давать рекомендации по профилактике заболеваний, связанных с воздействием водных факторов (передачей возбудителей инфекционных заболеваний через питьевую воду, неблагоприятным химическим составом воды), намечать меры по улучшению качества воды.
Требования к исходному уровню знаний: Для полного усвоения темы необходимо повторить:
ü из биологии — паразитарные и простейшие агенты, способные попадать в организм человека с водой, вызывая при этом заболевания;
ü микробиологии — патогенные бактерии и вирусы, продолжительность жизни которых в воде достаточно велика и, при этом, попадая в организм человека с водой, они способны вызывать заболевания;
ü физиологии — физиологическое значение воды для организма;
ü из химии — механизм бактерицидного действия хлора и механизм действия коагулянтов.
Контрольные вопросы из смежных дисциплин:
1. Физиолого-гигиеническое значение воды.
2. Роль воды в распространении инфекционных заболеваний.
3. Вода как фактор заболеваний неинфекционной природы.
Контрольные вопросы по теме занятия:
1. Общие требования к качеству питьевой воды.
2. Гигиеническое значение физических и органолептических свойств воды.
3. Причины, обусловливающие наличие в воде аммиака, аммонийных солей, нитритов и нитратов и санитарное значение наличия их в воде.
4. В чём заключается процесс минерализации органических веществ в водоёмах? Какие химические показатели свидетельствуют о свежем и давнем загрязнении воды?
5. Показатели наличия в воде органических веществ.
6. Что следует понимать под термином «улучшение качества воды»?
7. Методы улучшения качества воды.
8. Физические методы обеззараживания воды, преимущества и недостатки каждого из них.
9. Химические методы улучшения качества воды, преимущества и недостатки.
10. Коагуляция, отстаивание, фильтрация — сущность, выбор дозы коагулянта.
11. Хлорпотребность, хлорпоглощаемость воды.
12. Остаточный хлор, санитарное значение, сущность определения.
13. Специальные методы обработки воды.
УЧЕБНЫЙ МАТЕРИАЛ
Источниками воды для системы хозяйственного питьевого водоснабжения могут быть поверхностные водные объекты (реки, озёра, водохранилища) и запасы подземных вод (грунтовые, межпластовые напорные и безнапорные грунтовые воды), характеризующиеся непостоянным режимом, который целиком зависит от гидрометеорологических факторов — частоты выпадания и обилия осадков. Вследствие этого имеются значительные колебания по сезонам уровня стояния, дебита, химического и бактериального состава грунтовых вод. Химический состав подземных вод формируется под воздействием химического (выщелачивание, сорбция, ионный обмен, образование осадка) и физико-химического (перенос фильтрующих пород, смещение, поглощение и выделение газов) процессов. В подземных водах найдено около 70 химических элементов. Наибольшее значение для хозяйственно-питьевого водоснабжения имеют фтор, железо, соли жёсткости — сульфаты, карбонаты и бикарбонаты магния и кальция. Характерной особенностью межпластовых вод является отсутствие в них растворённого в воде кислорода.
Постоянство солевого состава воды — важнейший признак санитарной надёжности водоносного горизонта.
Общими свойствами поверхностных водоисточников являются:
1) низкая минерализация;
2) большое количество взвешенных частиц;
3) высокий уровень микробного загрязнения;
4) колебания расхода воды в зависимости от времени года и метеорологических условий;
5) чрезмерное развитие микроскопических водорослей (т. ч. цветение, ухудшающее органолептические свойства воды и придающее ей аллергическое действие);
6) интенсивное техногенное загрязнение в результате сброса промышленных и сельскохозяйственных сточных вод.
Таким образом, вода открытых водоисточников в 100 % случаев нуждается в улучшении качества. Вода подземных источников, особенно грунтовая, часто также не соответствует предъявляемым требованиям.
Для обеспечения населения водой применяется два вида водоснабжения — местное (децентрализованное) и централизованное. Их основное отличие — способ водоразбора. При местном водоснабжении вода разбирается непосредственно из водоисточника (колодца). При централизованном водоснабжении (водопровод) воду забирают из водоисточников механическим путём и по сети труб доставляют под давлением к месту потребления.
Централизованное водоснабжение, качество воды в котором регламентируется ГОСТом, преобладает в городах и городских посёлках. В сельской местности наиболее распространено децентрализованное водоснабжение с использованием неглубоких индивидуальных колодцев. Качество воды в них регламентируется санитарными нормами.
Требования к качеству воды можно разделить на три группы:
1) безопасность в эпидемическом отношении;
2) безвредность по химическому составу;
3) благоприятные органолептические свойства.
При оценке органолептических свойств воды определяют прозрачность, цветность, вкус, запах — показатели, которые в первую очередь могут настораживать потребителя.
Оценивая химический состав воды, надо помнить, что некоторые показатели являются природными (жёсткость, фтор, железо, йод), некоторые появляются или в результате загрязнений (сточные воды), или от избыточного применения средств улучшения качества воды (коагулянты, флокулянты).
Особое место занимает группа показателей, являющихся косвенным признаком фекального загрязнения воды, — определённых нестойких органических веществ в воде и продуктов их распада — солей аммония, нитритов и нитратов.
Следует учесть, что относительно невысокие концентрации, в которых эти соединения находятся в воде, сами по себе особого вреда для человека не представляют, но указывают на загрязнение воды органическими веществами животного (иногда растительного) происхождения. В эту группу можно отнести определение солей сернокислых и фосфорнокислых, а также хлоридов, которые служат характерным признаком загрязнения воды мочой и фекалиями.
То есть, оценка качества воды по химическому составу важна с одной стороны, как возможный источник различных заболеваний, вызванных высоким содержанием тех или иных химических элементов (йод, фтор, алюминий, хлорорганические углеводороды, хлориды, сульфаты, бор, бром, азот- и хлорсодержащие соединения), с другой стороны, как показатели загрязнения воды экскрементами человека и животных. Инфекционные заболевания, вызываемые поступившими при этом в воду патогенными бактериями, вирусами и простейшими или паразитарными агентами, представляет собой наиболее типичный и распространённый фактор риска для здоровья, связанный с питьевой водой. Инфекционная заболеваемость, связанная с водоснабжением, достигает 500 млн случаев в год. Учитывая этот фактор, можно сделать вывод о том, что вода, предназначенная для питья, приготовления пищи или для личной гигиены не должна содержать организмы, патогенные для людей.
Получение воды, не содержащей патогенных агентов, обеспечивается:
1) выбором незагрязнённых водоисточников;
2) эффективной очисткой и обеззараживанием воды (в случае её загрязнения фекалиями людей и животных);
3) гарантией того, что подготовленная вода не будет загрязнена в распределительной сети при подаче потребителю.
В качестве бактерии-индикатора фекального загрязнения взята эшерихия коли, которая в большей мере удовлетворяет следующим требованиям:
1) присутствует в больших количествах в фекалиях людей и теплокровных животных;
2) быстро обнаруживается с помощью простых методов;
3) не развивается в природной воде;
4) её персистентность в воде и степень удаления при очистке воды аналогичны таким же показателям для патогенов водного происхождения.
Однако, так как энтеровирусы и покоящиеся стадии криптоспоридиум, джардио, амёб и других паразитарных организмов обладают большей устойчивостью по сравнению с бактериями, то отсутствие кишечной палочки не обязательно указывает на отсутствие перечисленных возбудителей.
Таким образом, проблема качества питьевой воды имеет особую актуальность и значимость для жизнеобеспечения и охраны здоровья населения. Загрязнённая вода — причина массовых заболеваний, повышенной смертности, особенно детской, вызывающая рост социальной напряжённости. Результатом изысканий с целью гарантированного обеспечения безопасности и безвредности питьевой воды стал, в частности, выпуск нового издания «Руководство ВОЗ по контролю качества питьевой воды» с существенно расширенным и скорректированным перечнем нормируемых показателей и подготовка Директивы Европейского сообщества по вопросам качества воды, предназначенной для питьевых нужд, с регламентацией широкого круга нормативов, организованных форм и методов контроля. Для достижения установленных норм вода нуждается в очистке.
Очистка включает в себя следующие процессы:
Ø хранение;
Ø осаждение или удаление механических примесей, предварительная фильтрация;
Ø последующая фильтрация;
Ø обеззараживание.
Хранение — во время накопления воды в озёрах или водохранилищах микробиологическое качество воды существенно улучшается в результате отстаивания, бактерицидного действия УФ-излучения в поверхностных слоях, истощения питательных веществ для бактерий и деятельности конкурентных антагонистических организмов. При этом снижение содержания бактерий-индикаторов фекального загрязнения, сальмонелл и энтеровирусов составляет около 90 %, являясь наибольшим в летнее время с периодом сохранения в воде около 3–4 недель.
Если вода не проходила названные нормы хранения, производится предварительное обеззараживание. Это уничтожает живые биологические формы и снижает количество фекальных бактерий и патогенных штаммов бактерий, способствуя, кроме того, удалению водорослей во время коагуляции и фильтрации. Недостаток обеззараживания заключается в том, что когда хлор используется в большом количестве, могут образовываться хлорсодержащие органические соединения и биологически разлагаемый органический углерод.
▪ Осаждение или удаление механических примесей.
Фильтрование через мелкопористые фильтры со средним диаметром отверстий 30 мкм является эффективным способом удаления большого количества микроводорослей и зоопланктона, которые могут забивать фильтры или даже проникать через них. Этот процесс оказывает малое влияние на уменьшение количества фекальных бактерий и кишечных патогенов, прежде всего, из-за меньших размеров бактерий по сравнению со стандартной величиной пор фильтров.
▪ Коагуляция, флоккуляция и осаждение.
Коагуляция — процесс укрупнения, агрегации коллоидных и диспергированных примесей воды, происходящий вследствие их взаимного слипания под действием сил молекулярного происхождения. Коагуляция завершается образованием видимых невооружённым глазом агрегатов — хлопьев — крупных коацерватов. Образующиеся хлопья подвергаются осаждению, поглощая и захватывая природные окрашенные вещества, минеральные частицы и вызывая значительное снижение мутности и содержания простейших бактерий и вирусов. Для ускорения процесса коагуляции применяют, так называемые флоккулянты — высокомолекулярные синтетические соединения анионового и катионового типа.
Цель осаждения — сделать возможным оседание образующихся коацерватов и тем самым снизить концентрацию взвешенных твёрдых веществ, которые должны удаляться фильтрами. Быстрая и медленная фильтрация при правильной загрузке обеспечивает наибольшее улучшение качества воды при любом обычном способе очистки воды. Бактерии удаляются на 98–99 % и более. Содержание Е.coli снижается в 1000 раз, а удаление вирусов ещё больше. Медленная фильтрация через песок также очень эффективна при удалении паразитов (гельминтов и простейших).
Необходимо отметить, что при фильтрации происходит сорбция бактерий и вирусов на поверхности взвешенных частиц и хлопьев и совместное осаждение в отстойнике или порах фильтрующей загрузки. Часть бактерий и вирусов, оставаясь в воде свободными, проникает через очистные сооружения и содержится в фильтрованной воде.
Для создания надёжного и управляемого последнего барьера на пути возможной передачи через воду бактериальных и вирусных болезней применяется её обеззараживание. Для этого широко используются реагентные (хлорирование и озонирование) и безреагентные (УФ-излучения, воздействие гамма-лучами и другие методы).
Во многих странах для обеззараживания широко используется хлорирование. Обеззараживающий эффект оказывает гипохлоридный ион OCl – и недиссоциированная хлорноватистая кислота.
Процесс обеззараживания воды проходит в 2 стадии:
▪ обеззараживающий агент диффундирует внутрь бактериальной клетки;
▪ вступает в реакцию с энзимами клетки.
Скорость процесса зависит от кинетики диффузии обеззараживающего агента внутрь клетки и кинетики отмирания клетки в результате их метаболизма. Поэтому скорость обеззараживания возрастает:
Ø с увеличением концентрации обеззараживающего вещества в воде;
Ø повышением её температуры;
Ø с переходом обеззараживающего агента в недиссоциируемую форму, поскольку диффузия молекул через мембрану клетки происходит быстрее, чем гидратированных ионов, образующихся при диссоциации.
Эффективность обеззараживания снижается при наличии в воде органических веществ, способных к реакциям окисления-восстановления и других возможных восстановителей, а также коллоидных и взвешенных веществ, обволакивающих бактерии и мешающих контакту с ними обеззараживающего агента.
Интегральным показателем свойств воды, мешающих обеззараживанию, является хлорпоглощаемость, измеряемая количеством хлора, необходимого для окисления имеющихся в воде восстановителей. Она прямо пропорциональна дозе хлора и времени контакта.
На эффективность хлорирования оказывает влияние ряд факторов:
· биологические особенности микроорганизмов;
· бактерицидные свойства препаратов хлора;
· состояние водной среды;
· условия, в которых происходит обеззараживание.
Оптимальная доза активного хлора составляется из его количества, необходимого для удовлетворения хлорпоглощаемости воды, оказания бактерицидного действия и некоторого количества, так называемого, остаточного хлора, присутствующего в обеззараженной воде и свидетельствующего о завершении процесса обеззараживания.
Остаточный хлор, наряду с коли-индексом, служит косвенным показателем безопасности воды в эпидемиологическом отношении. Количество остаточного хлора нормируется СанПиН на разном уровне в зависимости от его состояния: для связанного (хлораминного) хлора — 0,8–1,2 мг/л. Для свободного (хлорноватистая или хлорная кислота — гипохлоридный ион) — 0,3–
0,5 мг/л. В указанном диапазоне концентраций остаточный хлор не изменяет органолептические свойства и в то же время может быть точно определён аналитическими методами. Содержание остаточного хлора нормируется в воде на выходе с водопроводной станции, после резервуаров чистой воды. Хлорированию, как методу обеззараживания воды, присущи некоторые недостатки:
· необходимость соблюдения многочисленных требований по технике безопасности;
· продолжительное время контакта для достижения обеззараживающего эффекта;
· образование в воде хлорорганических соединений, небезразличных для организма.
Однако уровень содержания побочных продуктов обеззараживания может быть снижен за счёт оптимизации технологии очистки. Удаление органических веществ перед обеззараживанием снижает вероятность образования потенциально опасных побочных продуктов, таких, как: хлорат, хлорит, хлорфенолы, тригалометаны (бромоформ, дибромхлорметан, хлороформ).
Одним из перспективных методов обеззараживания является озонирование. Преимущество озона перед хлором при обеззараживании воды состоит в том, что озон не образует в воде соединений, подобных хлорорганическим, улучшает органолептические свойства воды и обеспечивает бактерицидный эффект при меньшем времени контакта (до 10 мин). Озон более эффективен по отношению к патогенным простейшим, присутствующим в воде (лямблии, дизентерийная амёба). Однако широкое внедрение озонирования в практику обработки воды сдерживается высокой энергоёмкостью процесса получения озона.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Определение физических и органолептических свойств воды
Определение запаха воды
Техника исследования. Берут пробу воды, взбалтывают её и, открыв пробку, определяют в ней запах. Для усиления запаха 100 мл исследуемой воды наливают в колбу, накрывают часовым стеклом, подогревают до 50–60º, после чего колбу снимают с огня, воду взбалтывают, отнимают часовое стекло и определяют характер запаха.
По принятой классификации запахи воды характеризуются терминами: землистый (запахи влажной земли), болотный (запах торфа), аптечный (запах йодоформа), навозный, хлорный, сероводородный и т. д.
Интенсивность запаха выражается по пятибалльной системе в таблице 1.
Таблица 1
Определение интенсивности запаха воды
| Описательное определение | Балл | Интенсивность |
| Запах совсем не ощущается | Нет | |
| Запах, обычно не замечаемый, но обнаруживаемый привычным наблюдателем | Очень слабый | |
| Запах, обнаруживаемый, если обратить на него внимание потребителя | Слабый | |
| Запах, легко замечаемый. Может вызвать неодобрительные отзывы о воде | Заметный | |
| Запах, обращающий на себя внимание. Может заставить воздержаться от питья | Отчётливый (сильный) | |
| Запах настолько сильный, что вода совершенно не пригодна для питья | Очень сильный |
Нормы: централизованное водоснабжение — 2 балла, местное — 3 балла.
Определение вкуса воды
Для определения вкуса воду набирают в рот маленькими порциями, держат во рту несколько секунд и определяют вкус, не проглатывая её. Характеристику вкусового ощущения или привкуса описывают соответственно ощущению. Интенсивность вкуса и привкуса оценивается по пятибалльной системе:
никакого привкуса — 0 баллов;
очень слабый — 1 балл;
слабый — 2 балла;
заметный — 3 балла;
отчётливый — 4 балла;
очень сильный — 5 баллов.
Техника исследования. Вкус заведомо безвредной воды водопроводной, артезианских скважин, ключей и т. д. рекомендуется определять в момент взятия пробы воды. В случае подозрения на загрязнение определение вкуса производится в прокипячённой воде, остуженной до 11–15º.
Нормы: централизованное водоснабжение — 2 балла, местное — 3 балла.
Определение цветности воды
Для определения цвета исследуемую воду наливают в химический стеклянный стакан и рассматривают при дневном рассеянном освещении. Степень окраски воды характеризуется следующими терминами: бесцветная, слабо желтоватая, светло-желтоватая, жёлтая.
Количественное определение цветности проводится путём сравнения цвета исследуемой воды со шкалой стандартных растворов и выражается в условных градусах данной шкалы (табл. 2).
Таблица 2
Стандартная шкала для определения цветности
| Номер цилиндра | ||||||||||||
| Градусы цветности |
Техника исследования. В цилиндр наливают 100 мл профильтрованной исследуемой воды, смотрят сверху вниз в цилиндр на белом фоне и подбирают в стандартной шкале цилиндр, окраска раствора в котором соответствует цвету исследуемой воды.
Нормы: централизованное водоснабжение — 20º, местное — 30º.
Определение прозрачности воды
Техника исследования. Исследуемую воду хорошо взбалтывают и наливают в цилиндр. Под цилиндр кладут предметное стекло, на которое наклеен шрифт Снеллена. Затем постепенно выпускают воду через кран, находят максимальную высоту столбика воды, через который можно читать текст шрифта. Эта высота оставшегося столба воды, обозначенная в см, и выразит степень прозрачности.
Нормы: централизованное водоснабжение — 30 см, местное — 30 см.
Химический анализ воды
Определение реакции воды
Определение проводится электрометрическим методом стеклянными электродами.
Нормы: 6–9 рН при централизованном и местном водоснабжении.
Определение азотсодержащих солей
►Качественное определение солей аммиака с приближенной количественной оценкой (экспресс-метод).
Метод основан на способности аммиака (свободный аммиак и ионы аммония) образовывать комплексное соединение с реактивом Несслера, представляющего собой двойную соль йодистой ртути и йодистого калия, растворённых в едком калии. Образующийся в результате реакции йодистый меркураммоний окрашивает раствор в жёлтый цвет различной интенсивности в зависимости от количества аммиака.
Реактивы:
1. Реактив Несслера.
2. Тартрат калия-натрия (сегнетова соль), 50 %-ный раствор.
Техника определения. В пробирку диаметром 13–14 мм наливают 10 мл исследуемой воды, прибавляют 0,2–0,3 мл тартрата калия-натрия и 0,2 мл реактива Несслера. Через 10–15 мин проводят приближённое определение по таблице 3.
Таблица 3
Ориентировочное содержание аммиака и ионов аммония
| Окрашивание при рассматривании | Аммиак и ионы аммония | |
| Сбоку | Сверху | мг NH4+/л |
| Нет | Нет | 0,05 |
Окончание табл. 3
| Окрашивание при рассматривании | Аммиак и ионы аммония | |
| Нет | Чрезвычайно слабое желтоватое | 0,1 |
| Чрезвычайно слабое желтоватое | Слабо-желтоватое | 0,3 |
| Очень слабое желтоватое | Желтоватое | 0,5 |
| Слабо-желтоватое | Светло-жёлтое | 1,0 |
| Светло-жёлтое | Жёлтое | 2,5 |
| Жёлтое | Буровато-жёлтое | 5,0 |
| Мутноватое, резко-жёлтое | Бурое, раствор мутный | 10,0 |
Нормы: централизованное водоснабжение — 0 мг/л, местное — 0,1 мг/л.
► Качественное определение азота нитритов с приближённой количественной оценкой (экспресс-метод).
Метод основан на способности нитритных ионов давать интенсивно окрашенные диазосоединения с первичными ароматическими аминами. При определении используется реакция с сульфаниловой кислотой и альфа-нафтиламином (реактив Грисса) с образованием розовой окраски, интенсивность которой пропорциональна содержанию нитритов в воде.
Реактивы:
1. Реактив Грисса (10 %-ный р-р сухового препарата в 12 %-ной уксусной кислоте).
Техника определения. В пробирку диаметром 13–14 мм наливают 10 мл исследуемой воды, прибавляют 1 мл 10 %-ного реактива Грисса и нагревают до 50–60° С на водяной бане. Через 10 мин появившуюся окраску сравнивают со шкалой визуального определения (табл. 4). Для развития окраски без нагревания оставляют пробы на 15–20 мин при комнатной температуре.
Таблица 4
Ориентировочное содержание нитритов
| Окрашивание при рассматривании | Нитриты | |
| Сбоку | Сверху | мг NH4+/л |
| Нет | Нет | < 0,003 |
| Нет | Чрезвычайно слабое розовое | 0,003 |
| Едва заметное розовое | Очень слабо-розовое | 0,007 |
| Очень слабое розовое | Слабо-розовое | 0,013 |
| Слабо-розовое | Светло-розовое | 0,05 |
| Светло-розовое | Розовое | 0,10 |
| Розовое | Сильно-розовое | 0,20 |
| Сильно-розовое | Красное | 0,50 |
| Красное | Ярко-красное | 1,00 |
Нормы: централизованное водоснабжение — 0 мг/л, местное — 0,002 мг/л.
Определение хлоридов
Техника определения. В колбу наливают 100 мл исследуемой воды, прибавляют 2 капли хромово-кислого калия и титруют раствором азотно-кислого серебра до появления переходной окраски в розоватый цвет.
Пример расчета: на титрование 100 мл исследуемой воды пошло 3 мл раствора азотно-кислого серебра. Значит, в 100 мл испытуемой воды было 3 мг хлоридов, а в 1 л их будет 30 мг.
Нормы: централизованное водоснабжение 30–40 мг/л, местное — до
350 мг/л.
Определение жёсткости воды
►Определение общей жёсткости воды трилонометрическим методом.
Техника определения. В колбу наливают 100 мл предварительно профильтрованной исследуемой воды, добавляют 5 мл аммиачно-буферного раствора и 6 капель индикатора эриохром чёрного, затем медленно титруют 0,1 N раствором трилона Б до перехода винно-красной окраски в синюю.
Жёсткость анализируемой воды в миллиграмм-эквивалентах будет равна числу миллилитров 0,1 N раствора трилона Б, пошедшего на титрование 100 мл воды.
Нормы: централизованное водоснабжение до 7 мг-экв/л, местное — до
14 мг-экв/л.
Определение устранимой жёсткости воды
Техника определения. В колбу наливают 100 мл исследуемой воды, прибавляют 2 капли метилоранжа и титруют из бюретки 0,1 N раствором соляной кислоты до перехода жёлтой окраски в слабо-розовую; для лучшего улавливания перехода одного цвета в другой ставят рядом колбу с той же водой и с 2 каплями метилоранжа в ней.
Количество миллилитров 0,1 N раствора соляной кислоты, пошедшее на титрование 100 мл воды, соответствует жёсткости воды в миллиграмм-эквивалентах.
Не нормируется.
Определение окисляемости
Под окисляемостью воды понимают потребность в кислороде, необходимую для окисления веществ, содержащихся в воде. Она выражается показателем количества кислорода в миллиграммах, расходуемого на окисление веществ в 1 л воды.
Высокая окисляемость обусловливается наличием в воде продуктов распада органических веществ растительного и животного происхождения. В чистых питьевых водах она не превышает 5 мг кислорода на 1 л воды.
Определение окисляемости воды титрованием раствором марганцевокислого калия в кислой среде.
Этот метод основан на способности марганцево-кислого калия в кислой среде в присутствии органических веществ выделять атомарный кислород, который идет на их окисление.
Раствор марганцево-кислого калия при этом обесцвечивается вследствие превращения КМnO4 в MnSO4. По количеству разложившегося марганцево-кислого калия вычисляют окисляемость.
Реактивы:
1. 0,01 N раствор марганцово-кислого калия (1 мл этого р-ра выделяет 0,08 мг кислорода).
2. 0,01 N раствор щавелевой кислоты (1 мл этого р-ра требует на окисление 0,08 мг кислорода).
3. Раствор 25 %-ной серной кислоты.
Техника определения. 100 мл исследуемой воды наливают в колбу ёмкостью 250 мл, добавляют в колбу 5 мл 25 %-ного р-ра серной кислоты, 10 мл 0,01 N р-ра марганцово-кислого калия и нагревают жидкость до кипения. Предварительно в колбу опускают несколько кусочков пемзы.
После 10-минутного кипячения (считая с начала закипания) колбу снимают с нагревательного прибора, наливают в неё 10 мл 0,01 N р-ра щавелевой кислоты для разрушения, не вошедшего в реакцию с органическими веществами воды, КМnO4 и перемешивают содержимое колбы путём кругообразного взбалтывания.
Горячий раствор титруют 0,01 N р-ром марганцово-кислого калия до слабо розового окрашивания и по количеству израсходованного марганцово-кислого калия производят расчёт окисляемости. Однако предварительно следует определить количество миллилитров марганцово-кислого калия, идущего на 10 мл щавелевой кислоты и поправочный коэффициент марганцово-кислого калия. Для этого в колбу, содержащую ещё горячую оттитрованную до слабо-розового цвета жидкость, прибавляют 10 мл 0,01 N р-ра щавелевой кислоты и тотчас же титруют 0,01 N р-ром марганцово-кислого калия до такой же розовой окраски.
Поправочный коэффициент рассчитывается по формуле:

где К — поправочный коэффициент; V — количество миллилитров 0,01 N р-ра марганцово-кислого калия, израсходованного на титрование 10 мл щавелевой кислоты.
Расчёт окисляемости в миллиграммах на 1 л воды производится по формуле:

где V 1 — общее количество миллилитров 0,01 N р-ра марганцово-кислого калия, пошедшего на окисление 100 мл воды и на 10 мл щавелевой кислоты; V2 — количество миллилитров 0,01 N р-ра марганцово-кислого калия, идущего на окисление 10 мл 0,01 N р-ра щавелевой кислоты; К — поправочный коэффициент р-ра марганцово-кислого калия; 0,08 — количество миллиграммов кислорода, образуемое 1 мл 0,01 N р-ра марганцово-кислого калия; V — объём исследуемой воды в миллилитрах.
Нормы: централизованное и местное водоснабжение до 5 мг/л.
Определение растворённого в воде кислорода
Принцип метода: при прибавлении к воде хлористого марганца и едкого натра образуется осадок гидрата закиси марганца, который окисляется кислородом, растворённым в воде в гидрат окиси марганца, причём количество последнего будет эквивалентно количеству кислорода в воде. Гидрат окиси марганца окисляет в кислой среде йодистый калий, введённый ранее вместе со щёлочью, с образованием свободного йода в количестве, эквивалентному кислороду, растворённому в воде. Выделившийся йод отфильтровывают раствором гипосульфита натрия.
Ход реакций:
1. 2 МnCl2 + 4 NaOH = 4 NaCl + 2 Mn(OH)2↓.
2. 4 Mn(OH)2 + O2 + 2 H2O = 4 Mn(OH)3.
3. 2 Mn(OH)3 + 3 H2SO4 + 2 KI = 2 MnSO4 + K2SO4 + 6 H2O + I2.
4. I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6.
Из хода реакции видно, что О2 отвечает I2, на I2 идёт 2 Na2S2O3 (16 весовым частям кислорода соответствует 2,48 весовых частей гипосульфита натрия).
Техника определения.
1. К взятой пробе воды немедленно приливают на дно флакона 1 мл NaOH + KI, затем 1 мл 50 %-ного раствора МnCl2.
2. Закрывают флакон.
3. Хорошо взбалтывают воду.
4. Дают осесть образовавшемуся осадку гидрата окиси марганца.
5. Вливают во флакон 0,3 мл концентрированной H2SO4.
6. Снова закрывают флакон.
7. Взбалтывают пока растворится весь осадок марганца. Раствор осветляется и от выделившегося йода окрашивается в жёлтый цвет.
8. Жидкость из флакона переливают в колбу (400–500 мл).
9. Приступают к титрованию 0,01 N раствором гипосульфита.
10. Когда раствор приобретает бледно-жёлтый цвет, добавляют 1 мл
1 %-ного раствора крахмала и дотитровывают посиневший раствор до обесцвечивания.
Расчёт количества кислорода в мг в одном литре воды:
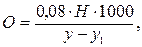
где 0,08 — число мг кислорода, соответствующее 1 мл 0,01 N раствора Na2S2O3; Н — число мл 0,01 N раствора гипосульфита; y — объём взятой для исследования воды (объём флакона); y1 — объём прилитых во флакон реактивов (всего
2 мл).
Определение биохимической потребности в кислороде
Принцип метода: при хранении исследуемой воды в закрытом сосуде происходит постепенная убыль в содержании растворённого кислорода за счёт поглощения его бактериями и мёртвыми органическими веществами. За критерий оценки воды в этом отношении условно принята величина уменьшения количества растворённого кислорода при 5-суточном хранении воды при 20 °С.
Вода из чистых водоёмов даёт при этих условиях хранения уменьшение кислорода не более 1–2 мг/л. В сильно загрязнённых водах через 5 сут. отмечается полное исчезновение кислорода.
Техника определения. Воду забирают из водоёма в бутыль (наполняют доверху) и доставляют в закупоренном виде в лабораторию. Для анализа воду переливают в колбу, согревают на водяной бане до 20 °С, взбалтывают в течение минуты для насыщения кислородом воздуха и наполняют доверху две калиброванные склянки с притёртыми пробками. В одной из склянок немедленно определяют содержание кислорода (методика описана выше), а другую ставят в термостат при 20 °С на 5 сут. Далее определяют растворённый в воде кислород. Разность между этими определениями, пересчитанная в мг на 1 л, показывает потребление кислорода на окисление нестойких органических соединений.
Бактериологический анализ воды
Определение микробного числа
На агар делается посев 1 мл воды. Через 24 ч после пребывания в термостате при 37º делаетс