Постулаты Клаузиуса и Кельвина логически следуют друг из друга. Показать это совсем не сложно.
Предположим сначала, что неверен постулат Клаузиуса. Тогда существует процесс  , единственным результатом которого является передача тепла
, единственным результатом которого является передача тепла  от менее нагретого тела
от менее нагретого тела  к более нагретому телу
к более нагретому телу 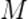 .
.
Возьмём тепловой двигатель, нагревателем которого является тело 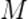 , а холодильником — тело
, а холодильником — тело  .
.
Двигатель подберём так, чтобы за цикл к холодильнику поступало как раз тепло  . Совершим один цикл, в ходе которого двигатель производит работу
. Совершим один цикл, в ходе которого двигатель производит работу  , после чего осуществим процесс
, после чего осуществим процесс  . Тепло
. Тепло  вернётся к телу
вернётся к телу 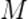 .
.
Тогда окажется, что в результате циклического процесса наш двигатель произвёл работу  единственно за счёт тепла, отведённого от нагревателя
единственно за счёт тепла, отведённого от нагревателя 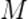 . Следовательно, неверен постулат Кельвина.
. Следовательно, неверен постулат Кельвина.
Наоборот, предположим, что неверен постулат Кельвина. Тогда существует циклический процесс  , единственным результатом которого является получение работы
, единственным результатом которого является получение работы  за счёт тепла, отводимого от некоторого резервуара
за счёт тепла, отводимого от некоторого резервуара  .
.
Возьмём тело 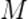 — более горячее, чем
— более горячее, чем  . Запустим процесс
. Запустим процесс  . От тела
. От тела  будет отведено тепло
будет отведено тепло  . Полученную работу
. Полученную работу  превратим во внутреннюю энергию тела
превратим во внутреннюю энергию тела 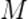 (например, с помощью трения).
(например, с помощью трения).
В итоге мы осуществим процесс, единственным результатом которого является передача тепла  от менее нагретого тела
от менее нагретого тела  к более нагретому телу
к более нагретому телу 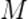 . Никаких других изменений не произошло (ведь процесс
. Никаких других изменений не произошло (ведь процесс  — циклический!). Стало быть, постулат Клаузиуса неверен.
— циклический!). Стало быть, постулат Клаузиуса неверен.
В листке «Тепловые машины» мы отметили, что изотермические и адиабатные процессы делают машину Карно обратимой, но не объяснили — почему.
Кроме того, в этом листке было сказано, что все реальные процессы необратимы. Как это увязать с упомянутой обратимостью цикла Карно?
Прежде всего, нужно рассказать о важнейшей (наряду с идеальным газом) идеализации в термодинамике — равновесных обратимых процессах.
Обратимые процессы
Равновесное состояние газа (и вообще любой термодинамической системы) — это состояние теплового равновесия (вспоминайте листок «Температура»!). В этом состоянии определены значения макроскопических параметров: давления, объёма, температуры...Равновесное состояние может быть изображено точкой на диаграммах состояния (т. е.  -,
-,  - и
- и  -диаграммах).
-диаграммах).
Равновесный процесс представляет собой последовательную цепочку близких равновесных состояний. Равновесный процесс может быть изображён непрерывной линией на диаграммах состояния.
Как вы теперь понимаете, все процессы, графики которых мы рассматривали в предыдущих листках, предполагались равновесными — ведь только в этом случае можно говорить о «графике процесса».
Процесс можно считать равновесным, если параметры газа меняются достаточно медленно. Настолько медленно, что в каждый момент времени будет успевать устанавливаться новое равновесное состояние. Такие медленные равновесные процессы называют ещё квазистатическими.
Вот пример квазистатического (равновесного) процесса. Пусть имеется вертикальный цилиндр с газом под поршнем. Положим на поршень песчинку. Потом другую, третью, сотую, тысячную. Получим чрезвычайно медленное сжатие газа, представляющее собой череду сменяющих друг друга равновесных состояний.
Теперь начнём снимать песчинки обратно, всё так же по одной. Получим квазистатическое равновесное расширение газа. При этом газ пройдёт в обратном направлении те же самые состояния, которые он проходил в предыдущем процессе равновесного сжатия. Действительно, раз уж при каждом положении поршня успевает установиться тепловое равновесие, то значения макроскопических параметров определяются только самим положением поршня, но не направлением его движения.
Мы видим, что равновесный процесс является обратимым — его можно провести в обратном направлении через ту же самую цепочку равновесных состояний. На диаграммах состояния обратимый процесс идёт по одной и той же линии как в прямом, так и в обратном направлении.
Если же вместо песчинок поставить на поршень увесистую гирьку, то процесс сжатия газа пойдёт весьма быстро. Давление газа непосредственно под поршнем будет больше, чем у дна сосуда, и мы уже не сможем охарактеризовать состояние газа в каждый момент времени каким-то одним значением давления. Состояния, проходимые газом, не будут состояниями теплового равновесия (макроскопические параметры не успевают принимать определённые значения для всего газа). Стало быть, процесс быстрого сжатия газа будет неравновесным.
Кроме того, такой процесс будет необратимым. Ведь если столь же быстро расширять газ, то давление непосредственно под поршнем теперь окажется меньше, чем у дна сосуда. Следовательно, при быстром расширении газ проходит через иную цепочку состояний, чем в процессе сжатия.
Процессы, идущие бесконечно медленно, являются обратимыми. Это идеализация. Реальные процессы идут с конечной скоростью и потому необратимы.