Методы получения алкинов. Получение ацетилена.
Общий способ получения алкинов — отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи.
| С2Н5ОН | ||
| СН2Вr - СН2Вr + 2КОН | → | НС ≡ СН + 2КВr + 2Н2О, |
| С2Н5ОН | |||
| СН3 - СВr2 - СН3 + 2КОН | → | СН3-С ≡ СН + 2КВr + 2Н2О, |
В лабораторных условиях ацетилен получают гидролизом карбида кальция:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2 ↑
22. Реакции электрофильного замещения (SЕ) у аренов. Галогенирование, нитрование, сульфирование, алкилирование, ацилирование ароматических соединений (бензола, толуола, анилина, фенола, нитробензола). Правила ориентации в бензольном кольце.
Механизм реакции SEAr или реакции ароматического электрофильного замещения

В ходе реакции образуется промежуточный положительно заряженный интермедиат (на рисунке — 2b). Он носит название интермедиат Уэланда,арониевый ион или σ-комплекс. Этот комплекс, как правило, очень реакционноспособен и легко стабилизируется, быстро отщепляя катион.
Лимитирующей стадией в подавляющем большинстве реакций SEAr является первый этап.
Галогенирование бензола бромом, хлором или йодом приводит к образованию арилгалогенидов. Катализатором реакции выступает галогенид железа (III):

Образование активной частицы[2]:

Нитрование ароматических систем азотной кислотой в присутствии серной кислоты с получением нитросоединений:

Образование активной частицы[2]:

Сульфирование бензола с получением сульфокислоты:

Активной частицей в реакции является SO3.
Реакция Фриделя-Крафтса — ацилирование или алкилирование с использованием ацил- или алкилгалогенидов. Типичным катализатором реакции служит хлорид алюминия, но может использоваться любая другая сильная кислота Льюиса.



24. Способы получения аренов: получение бензола и толуола.


Одноатомные первичные, вторичные и третичные спирты. Химические свойства одноатомных спиртов – взаимодействие с металлами, реакция этерификации.
По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R—CH2—OH), вторичные (R—CHOH—R') и третичные (RR'R''C—OH) спирты.
| Первичный спирт: | Вторичный спирт: | Третичный спирт: |
| CH3CH2CH2CH2—OH бутанол-1 (бутиловый сприт) | 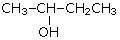 бутанол-2 (втор-бутиловый спирт) бутанол-2 (втор-бутиловый спирт)
|  2-метилпропанол-2 (трет-бутиловый спирт) 2-метилпропанол-2 (трет-бутиловый спирт)
|
CnN2n+2O - общая формула и предельных одноатомных спиртов, и простых эфиров.

Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).


Галогенирование, дегидратация и окисление одноатомных спиртов. Понятие о нуклеофильном замещении и элиминировании.
Галогенирование (присоединение галогенов)
Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной температуре, без катализатора). Например, быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи:

Еще легче происходит присоединение хлора:

Эти реакции протекают по механизму электрофильного присоединения с гетеролитическим разрывом связей в молекуле галогена.
При нагревании до 500°С возможно радикальное замещение атома водорода при соседнем к двойной связи атоме углерода:

Реакции дегидратации спиртов
Отщепление воды от молекул спирта (дегидратация спиртов) в зависимости от условий происходит каквнутримолекулярная или межмолекулярная реакция.
1. Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании выше 140 °С.
Например:

В тех случаях, когда возможны 2 направления реакции, например:

дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного атома углерода).
2. Межмолекулярная дегидратация спиртов происходит при температуре ниже 140 °С с образованием простых эфиров:
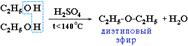
В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.

При окислении вторичных спиртов образуются кетоны.
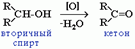
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Реакции нуклеофильного замещения – наиболее типичный круг реакций, в которых галогенуглеводороды выступают в качестве субстратов. Результатом этих реакций является замещение галогена на другой атом или группу, которые либо непосредственно выступают в роли нуклеофильного реагента, либо входят в его состав в качестве фрагмента.
Наиболее типичными реакциями нуклеофильного замещения галогеналканов и других галогенпроизводных являются:
а) реакции гидролиза
RHal + H2O ROH + HHal
RHal + NaOH ROH + NaHal
б) реакции образования простых эфиров (реакция Вильямсона)
RHal + R`ONa ROR` + NaHal
в) синтез сложных эфиров
R1Hal + RCOONa RCOOR1 + NaHal
г) аммонолиз
RHal + 2NH3 RNH2 + NH4Hal
д) синтез нитросоединений и нитритов
RHal + NaNO2  RNO2 + NaHal
RNO2 + NaHal
RHal + NaNO2  RONO + NaHal
RONO + NaHal
е) синтезнитриловиизонитрилов
RHal + NaCN  RCN + NaHal
RCN + NaHal
RHal + NaCN  RNC + NaHal
RNC + NaHal
ж) синтез тиолов и сульфидов
R–Hal + NaSH RSH + NaHal
R–Hal + R1SNa RSR1 + NaHal
2R–Hal + Na2S RSR + 2NaHal
з) синтез фосфорорганических соединений

(CH3)2PH + CH3CH2Br + NaOH (CH3)2PCH2CH3 + NaBr + H2O
диметилэтилфосфин

и) синтез углеводородов на основе Mg-органических соединений
R – MgHal + R’Hal R–R’ + MgHal2
к) замещение галогена на галоген
RX + NaY RY + NaY
Из приведенных реакций можно видеть, что реакции нуклеофильного замещения могут служить методом образования связей С–С, С–О, С–S, C–N, C–P и C–Hal.