Модуль 1. Поверхностные свойства дисперсных систем
Задание 1.1 Адсорбция
В табл. 1 представлена зависимость массы вещества (мг), поглощенного 1 г адсорбента при температуре 298 К, от равновесного парциального давления.
По представленным данным:
1. Постройте изотерму адсорбции А =f (P).
2. Постройте полученную изотерму в координатах уравнения Ленгмюра, определите константы в уравнении графическим методом.
3. Определите величину максимальной адсорбции при полном заполнении поверхности сорбента.
4. Определите величину адсорбции при давлении Р1.
5. Постройте полученную изотерму в координатах уравнения Фрейндлиха и определите константы уравнения.
Таблица 1
| № | Адсорбент | Адсорбат | Р ·10–3 (Па) | А (мг) |
| Цеолит | СО2 | 0,1 1,0 7,5 20,0 | 35,0 112,0 174,0 188,0 | |
| АУ | СО2 | 1,0 4,48 14,4 25,0 | 32,3 66,7 117,2 145,0 | |
| Силикагель | Пары воды | 0,30 0,77 1,17 1,40 1,78 | 79,2 166,0 210,0 238,0 268,0 | |
| АУ | СО2 | 0,99 4,97 9,98 20,0 29,7 | 32,0 70,0 91,0 102,0 107,3 | |
| АУ | Пары бензола | 0,05 0,085 0,149 0,849 1,599 | 136,5 163,8 183,3 214,5 280,8 | |
| АУ | СО2 | 4,2 8,1 11,7 16,5 24,0 | 12,7 21,2 26,4 32,3 38,6 | |
| АУ | СО | 9,8 24,2 41,3 60,0 72,5 | 2,53 5,57 8,43 11,2 12,85 | |
| АУ | NH3 | 15,5 26,6 47,7 70,6 90,2 | 64,4 94,3 119,7 132,0 137,4 | |
| цеолит | Н2S | 5,2 7,9 21,0 31,6 65,8 | 25,0 30,0 48,0 53,0 66,0 | |
| цеолит | Н2S | 7,9 18,4 34,2 65,8 100,0 | 78,0 100,0 110,0 120,0 128,0 | |
| АУ | метан | 25,6 36,7 47,8 60,5 77,0 | 25,2 29,1 32,3 35,3 38,4 | |
| АУ | СО | 4,00 5,34 9,65 16,65 19,8 | 15,8 19,0 27,7 34,1 39,9 | |
| АУ | этилен | 9,35 12,4 22,5 42,6 82,5 | 39,5 42,8 49,9 56,5 64,5 | |
| АУ | этилен | 2,0 4,27 10,57 29,5 91,5 | 10,4 20,8 30,5 42,4 55,2 | |
| АУ | Пары этанола | 0,813 1,214 1,981 2,744 3,914 | 0,813 1,214 1,981 2,744 3,914 | |
| АУ | Пары бензола | 0,399 0,799 1,33 2,264 5,328 | 200,0 230,0 250,0 270,0 290,0 | |
| цеолит | СО | 5,18 16,0 45,3 74,2 82,1 | 9,8 30,4 50,8 70,4 100,31 | |
| цеолит | Оксиды азота | 3,53 4,65 6,7 8,55 12,5 | 3,17 3,70 4,40 5,09 6,14 | |
| алюмогель | СО | 11,3 24,4 44,5 61,00 82,5 | 2.04 3,72 5,30 6,34 7,3 | |
| уголь | метан | 7,51 11,15 17,3 23,9 33,9 | 18,1 24,0 30,1 37,3 42,4 | |
| Цеолит | Оксиды азота | 17,3 18,6 30,3 35,3 47,3 | 6,7 7,35 8,48 9,07 9,92 | |
| Силикагель | Азот | 4.8 11,9 20,6 41,0 98,0 | 108,2 133,9 171,7 176,0 188,9 | |
| Слюда | СО | 7,5 13,9 60,0 72,7 105,0 | 10,82 13,39 17,17 17,60 18,90 | |
| Силикагель | Пары воды | 13.5 26,3 39,8 53,0 | 3,0 5,5 7,6 9,4 | |
| Уголь | Пары толуола | 0,1 0,17 0,30 1,70 3.2 | 163.2 196,56 219,96 257,4 336,96 |
Пример 1.1
|
|
При адсорбции аммиака активированным углем (АУ) при температуре 273 К получены следующие результаты:
| Р· 10–3(Па) | 10,5 | 21,6 | 42,7 | 65,6 | 85,2 |
| А (мг/г) | 60,4 | 90,3 | 115,7 | 127,0 | 132,4 |
Постройте изотерму адсорбции. Определите константы в уравнении Ленгмюра.
Решение
Адсорбция газа на поверхности твердых тел при температуре Т, протекающая по мономолекулярному механизму, описывается уравнением Ленгмюра:
 , (1)
, (1)
где: А∞ – емкость монослоя, (мг/г или ммоль/г)
К - константа равновесия адсорбции,
Р - равновесное давление газа, (Па)
Константы в уравнении Ленгмюра определяют графическими или аналитическими методами по соотношению:
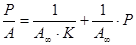 (2)
(2)
При адсорбции из растворов уравнение Ленгмюра принимает вид:
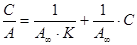 (3)
(3)
Константы в уравнении Ленгмюра определяют по соотношению (2).
Определяем величины Р/А:
| Р ·10–3(Па) | 10,5 | 21,6 | 42,7 | 65,6 | 85,2 |
| Р/А· 10–3 | 0,17 | 0,24 | 0,37 | 0,52 | 0,64 |
По полученным данным строим график зависимости Р/А от Р (рис.1.)
По тангенсу угла наклона полученной прямой определяем 1/А∞:
tga = (0,37–0,24) / (42,7–21,6) = 0,006, tga = 1 / А ∞
|
|
Следовательно, А ∞= 1 / tga = 1 / 0,006 = 162,3 мг/г.

Рис.1. Изотерма, построенная в координатах уравнения Ленгмюра
По отрезку, отсекаемому полученной прямой, на оси ординат определяем 1/ А∞ К. Отрезок равен 0,11. Отсюда:

Уравнение Ленгмюра:

Пример 1.2.
При адсорбции паров бензола на коксе при температуре 298 К получены следующие результаты:
| Р ·10–3(Па) | 25,6 | 36,7 | 47,8 | 60,5 | 77,0 |
| А (мг/г) | 15,2 | 19,1 | 22,3 | 25,3 | 28,4 |
Постройте изотерму адсорбции. Рассчитайте константы в уравнении Фрейндлиха.
Для средних степеней заполнения поверхности адсорбента и при адсорбции на неоднородной поверхности используют уравнение Фрейндлиха:
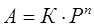 , (4)
, (4)
где: К и n – коэффициенты, определяемые экспериментально.
Для определения коэффициентов в уравнении (3) его логарифмируют и представляют в виде:
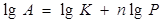 (5)
(5)
Затем строят зависимость lg A= f(Р) и графически определяют коэффициенты в уравнении.
По представленным данным строим изотерму адсорбции (Рис.2)

Рис.2. Изотерма адсорбции бензола на коксе.
Для определения констант в уравнении Фрейндлиха представим уравнение в логарифмическом виде:
| lg Р | 4,41 | 4,56 | 4,68 | 4,78 | 4,89 |
| lg А | 1,18 | 1,28 | 1,35 | 1,40 | 1,45 |
По полученным данным строим график зависимости lg А от lg Р (рис.3).

Рис.3. Изотерма адсорбции, построенная в координатах уравнения Фрейндлиха.
По тангенсу угла наклона полученной прямой определяем константу n:
tga = (1,4–1,18) / (4,78–4,41) = 0,59, n = 0,59
Коэффициент К определим по известному значению n:

Уравнение Фрейндлиха:
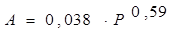
Модуль 2. Методы получения дисперсных систем. Термодинамические, кинетические свойства. Агрегативная устойчивость.
|
|
Задание 2.1
| Вариант 1 | Вариант 2 | Вариант 3 | Вариант 4 | ||||
| Время, с | Масса, мг | Время, с | Масса, мг | Время, с | Масса, мг | Время, с | Масса, мг |
По приведённым данным постройте кривую седиментации, рассчитайте и постройте дифференциальную кривую распределения частиц по размерам для водных суспензий оксида титана различной дисперсности. Плотность воды при 25 0С примите равной 0,998 г/см3, вязкость воды 0,89 мПа⋅с, плотность оксида титана 4,25 г/см3, высоту осаждения 0,12 м. Табл.2
По приведённым данным постройте кривую седиментации и дифференциальную кривую распределения частиц по размерам для водных суспензий оксида алюминия различной дисперсности. Плотность воды при 25 0С примите равной 1,0 г/см3, вязкость 0,89 мПа с, плотность оксида алюминия 3,5 г/см3, высоту оседания 0,1 м. Табл.3
| Вариант 5 | Вариант 6 | Вариант 7 | Вариант 8 | ||||
| Время, с | Масса, мг | Время, с | Масса, мг | Время, с | Масса, мг | Время, с | Масса, мг |
По приведённым данным постройте кривую седиментации и дифференциальную кривую распределения частиц по размерам для водных суспензий талька различной дисперсности. Плотность воды при 25 0С примите равной 1,0 г/см3, вязкость 0,89 мПа с, плотность талька 1,75 г/см3, высоту оседания 0,12 м.
Табл.4
| Вариант 9 | Вариант 10 | ||
| Время, с | Масса, мг | Время, с | Масса, мг |
11. Построить кривую распределения суспензии цинка в ацетоне, пользуясь следующими экспериментальными данными:
| |||||||||||||||||
12. Используя экспериментальные данные седиментации молотого вольского песка в воде, построить кривую оседания и дифференциальную кривую распределения по радиусам.
| |||||||||||||||||
13. Используя экспериментальные данные построить кривую оседания суспензии вольского песка в трансформаторном масле.
| |||||||||||||||||
14. Используя экспериментальные данные построить кривую оседания песка в анилине, рассчитать и построить кривую распределения суспензии.
| |||||||||||||||||
15. Построить кривые оседания и распределения по радиусам суспензии двуокиси титана в бутилацетате, используя следующие экспериментальные данные.
|
| Вариант 16 | Вариант 17 | Вариант 18 | Вариант 19 | |||||
| Время, с | Масса, мг | Время, с | Масса, мг | Время, с | Масса, мг | Время, с | Масса, мг | |
По нижеприведённым данным постройте кривую седиментации, рассчитайте и постройте дифференциальную кривую распределения частиц по размерам для водных суспензий оксида лантана различной дисперсности. Плотность воды при 25 0С примите равной 0,997 г/см3, вязкость воды 0,89 мПа⋅с, плотность оксида лантана 6,51 г/см3, высоту осаждения 0,15 м. Табл.5
Задание 3.1
При медленном введении вещества В в разбавленный раствор вещества А возможно образование гидрозоля вещества С (вещество А – в избытке). Напишите формулу мицеллы и укажите знак электрического заряда коллоидных частиц этого золя.
Таблица 6
| № варианта | А | В | С |
| MgCl2 | NaOH | Mg(OH)2 | |
| CaCl2 | H2SO4 | CaSO4 | |
| AlCl3 | NaOH | Al(OH)3 | |
| Pb(NO3)2 | KI | PbI2 | |
| ZnCl2 | KOH | Zn(OH)2 | |
| CdCl2 | H2S | CdS | |
| AgNO3 | NaCl | AgCl | |
| Cu(NO3)2 | NaOH | Cu(OH)2 | |
| NiCl2 | (NH4)2S | NiS | |
| BaCl2 | Na2SO4 | BaSO4 | |
| Na2SiO3 | HCl | H2SiO3 | |
| FeCl3 | KOH | Fe(OH)3 | |
| AsCl3 | H2S | As2S3 | |
| AgNO3 | KBr | AgBr | |
| ZnSO4 | (NH4)2S | ZnS | |
| NiCl2 | NaOH | Ni(OH)2 | |
| CuCl2 | Na2S | CuS | |
| Cd(NO3)2 | KOH | Cd(OH)2 | |
| CoCl2 | NaOH | Co(OH)2 | |
| CrCl3 | NaOH | Cr(OH)3 | |
| Pb(NO3)2 | Na2S | PbS | |
| Pb(NO3)2 | NaOH | Pb(OH)2 | |
| FeCl2 | Na2S | FeS | |
| Pb(NO3)2 | Na2SO4 | PbSO4 | |
| Sn(NO3)2 | Na2S | SnS |
Задание 3.2
Определите агрегатные состояния дисперсной фазы и дисперсионной среды для предложенных систем. Назовите систему.
Табл.7
| Вариант | Дисперсные системы |
| 1. | Пожарная пена; порошок |
| 2. | Нефть; пыльный воздух |
| 3. | Туман; керосин в воде |
| 4. | Мазут; глина в воде |
| 5. | Паста; облако |
| 6. | Смазочные материалы; дым |
| 7. | Угольная пыль, бетон |
| 8. | Чугун, пенобетон |
| 9. | Цементная суспензия, сталь |
| 10. | Активированный уголь, пыль |
| 11. | Туман, космическая пыль |
| 12. | Силикагель, пемза |
| 13. | Мыльная пена, нефть |
| 14. | Стекла, порошки |
| 15. | Керамика, мазут |
| 16. | Майонез, дым |
| 17. | Яичный белок, пудра |
| 18. | Крем, пульпа |
| 19. | Зубная паста, взвесь |
| 20. | Масляная краска, золь серы в воде |
| 21. | Мед, строительная пена |
| 22. | След от реактивного самолета в небе, дым |
| 23. | Сернокислотный туман, молоко |
| 24. | Золь золота, сливочное масло |
| 25. | Пенопласт, жемчуг |
| Гуталин, туман | |
| Алюминиевая пудра, облако | |
| Сметана, минерал | |
| Взвесь, активированный уголь | |
| Чугун, защитная завеса |
Пример 3.1.
Пользуясь экспериментальными данными, построить кривую оседания оксида алюминия в воде, рассчитать и построить кривую распределения суспензии:
| Время оседания t, с | ||||||||
| Масса осадка, г | 0,023 | 0,028 | 0,032 | 0,035 | 0,036 | 0,037 | 0,038 | 0,038 |
Плотность Al2O3 – 3,9 кг/м3, плотность воды 103 кг/м3, вязкость воды 10–3 Па×с, высота столба жидкости 11,5×10–2 м.
Решение. По данным таблицы строят кривую седиментации, откладывая по оси ординат массу осадка m (г), по оси абсцисс – время оседания t (с) кривую чертят в масштабе, удобном для дальнейшего графического расчета.
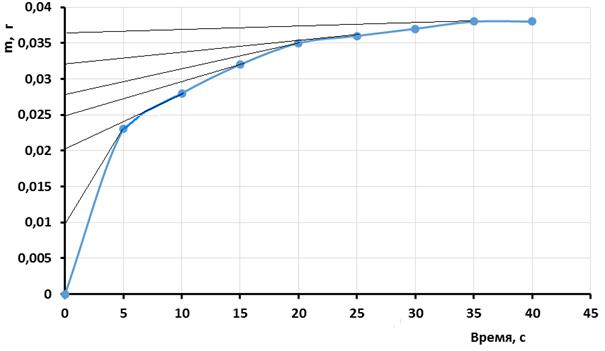
Рис. 4. Кривая седиментации частиц оксида алюминия
На кривой седиментации произвольно выбирают несколько точек и проводят к ним касательные до пересечения с осью ординат. Отрезки на оси ординат между двумя соседними касательными дают массу частиц D mг с определенным радиусом ri, полностью выпавших в осадок ко времени t.
Радиус частиц ri(м) каждой фракции D mг рассчитывают по формуле 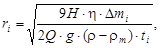
где Н – высота столба жидкости, м;
g – ускорение свободного падения, м/с (g = 9.8 м/с 2);
h - вязкость жидкости, Па×с (для воды h = 10–3 Па×с);
D mi – масса фракции, кг;
Q – масса осадка, кг (Q = m мах);
r, rm – плотность твердой и жидкой фаз, кг/м3;
ti – время седиментации данной фракции, с;
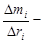 отношение массы фракции к разности радиусов частиц соседних фракций.
отношение массы фракции к разности радиусов частиц соседних фракций.
Результаты расчета заносят в табл.8.
Таблица 8
| № п/п | Время седиментации, D mi, с | Масса осадка, m× 106, кг | Масса фракции D mi× 106, кг | Средний радиус частиц фракции, ri× 105, м | Разность радиусов соседних фракций,D ri× 105, м | Функция распределения D mi /D ri |
| 19,5 | 8,5 | 2,86 | 2,86 | 0,30 | ||
| 30,5 | 2,20 | 0,66 | 1,52 | |||
| 5,5 | 1,34 | 0,86 | 0,64 | |||
| 3,5 | 0,92 | 0,42 | 0,83 | |||
| 3,5 | 0,83 | 0,09 | 3,89 | |||
| 48,5 | 0,57 | 0,26 | 0,77 | |||
| 0,84 | 0,27 | 1,85 | ||||
| 0,77 | 0,07 | 7,14 |
Далее строят дифференцированную кривую распределения. На оси абсцисс откладывают значения радиусов, на оси ординат наносят отношение приращения массовых долей к разности радиусов частиц соседних фракций D mi /D ri. Построив на графике отдельные прямоугольники для каждой фракции (гистограмму) и соединив плавной кривой середины их верхних сторон, получают дифференцированную кривую распределения частиц по размерам.

Рис.5. Дифференциальная кривая седиментации частиц
Пример 3.2.
Напишите реакцию получения золя гидроксида цинка путем взаимодействия растворов хлорида цинка(II) и гидроксида натрия в эквимолярном соотношении. Составьте формулу мицеллы гидрозоля гидроксида цинка, если в избытке взят раствор хлорида цинка. Определите заряд частиц (гранул) золя.
Решение:
ZnСl2 +2 NaОН = Zn(ОН)2 ↓ + 2NaCl
или в ионном виде:
Zn2+ + 2ОН– = Zn(ОН)2↓
Агрегат: m (Zn(ОН)2)
Потенциалопределяющими ионами служат ионы Zn2+, так как ZnCl2 в избытке.
Формула мицеллы гидроксида цинка:
{[ m (Zn(ОН)2) • n Zn2+] • 2 (n–x) Cl-}2x+ 2 x Cl-
Заряд частицы равен 2 х +.
m – число молекул Zn(ОН)2 (агрегат основного вещества);
n – число потенциалоопределяющих ионов;
(n – х) – число противоионов в адсорбционном слое;
х – число противоионов в диффузионном слое.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Е.Д. Щукин, А.В. Перцов, Е.А. Амелина. Коллоидная химия: Учебник для бакалавров. –М.– «Юрайт», 2013.– 444 с.
2. П.М. Кругляков, А.В. Нуштаева, Н.Г. Вилкова, Н.В. Кошева. Физическая и коллоидная химия. Практикум: учебное пособие. – С-Пб.: «Лань», 2013.– 208 с.
3. М.И. Гельфман, О.В. Ковалевич, В.П. Юстратов. Коллоидная химия. –
С-Пб. – М.- Краснодар: «Лань», 2007. – 333 с.
4. Ж. Н. Малышева, И.А. Новаков. Теоретическое и практическое руководство по дисциплине "Поверхностные явления и дисперсные системы". Учебное пособие. - Волгоград: Политехник, 2007.– 343 с.
5. Физическая и коллоидная химия. Поверхностные явления. Учебно-методическое пособие. /Сост. Козлова Г.А., Тиньгаева Е.А., Пермь, Изд-во ПНИПУ, 2012. – 79 с.
6. Физическая и коллоидная химия. Дисперсные системы. Учебно-методическое пособие. /Сост. Тиньгаева Е.А., Козлова Г.А. и др., Пермь, Изд-во ПНИПУ, 2014. – 90 с.