Содержание
1. Интерметаллиды и их структура………………………………………….3
2. Структуры гидридов……………………………………………………...10
3. Структуры галогенидов…………………………………………………..12
4. Структуры оксидов и халькогенидов……………………………………14
5. Структуры CdI2 и CdCl2..............................................................................19
6. Бинарные соединения и структура в α-Al2O3…………………………...22
Интерметаллиды и их структура
Интерметаллиды - химические соединения двух или нескольких металлов. Они относятся к металлическим соединениям.
Интерметаллиды образуются в результате взаимодействия компонентов при сплавлении, конденсации из пара, а также при реакциях в твердом состоянии вследствие взаимной диффузии (при химико-термической обработке), при распаде пересыщенного твердого раствора одного металла в другом, а также в результате интенсивной пластической деформации при механическом сплавлении (механоактивации). Для интерметаллидов характерны преимущественно металлический тип химической связи и специфические металлические свойства. Однако среди интерметаллидов имеются также солеобразные соединения с ионной связью (так называемые валентные соединения, образующиеся из элементов различной химической природы и представляющие собой стехиометрические соединения), например NaAu, соединения с промежуточным характером связи - ионно-металлической и ковалентно-металлической, а также с ковалентной. Так, в ряду соединений Mg с элементами подгруппы IVa вместе с уменьшением различия в электрохимических характеристиках компонентов наблюдается и изменение свойств интерметаллидов - от характерных для ионных соединений (Mg2Si, Mg2Ge) к свойствам, типичным для металлов (Mg2Pb). В соединениях структурного типа NiAs (рис. 1) или родственных типов Ni2In, NiTe2 или CdI2, представляющих собой соединения переходных металлов подгрупп VIIб, VIIIб и металлов подгруппы Сu с элементами подгрупп IIIa-VIa (так называемых никель-арсенидные фазы, или фазы Макарова), сложная природа химической связи, которая изменяется с изменением положения компонентов в периодической системе; одновременно изменяется и состав интерметаллидов. Для соединений состава АВ характерна ковалентно-металлическая связь; при изменении состава интерметаллидов от АВ2 (напр., NiTe2) до А2В (напр., Ni2In) наблюдается изменение природы связи - от преобладающей ионно-ковалентной до металлической.

Кристаллическая структура. Классификация интерметаллидов по кристаллическим структурным типам плохо коррелирует с типами химической связи, т. к. одни и те же структуры могут быть у соединений с различной природой химической связи. Можно лишь выделить структуры с низкими координационными числами (к. ч.), характерные для интерметаллидов с ковалентной связью. При этом атомы элемента из подгрупп б периодической системы в структуре типа СаF2 расположены внутри тетраэдра (к. ч. = 4, напр., PtAl2, AuIn2), а в структуре типа NiAs - в центре тригональной призмы (к. ч. = 6). Структуры ионных и металлических кристаллов можно рассматривать как плотные упаковки сферических частиц. Благодаря плотной упаковке одни и те же структурные типы характерны для кристаллов с ионным и металлическим типом связи. Главный параметр, определяющий возникновение того или иного структурного типа для ионных и металлических кристаллов, - отношение соответствующих ионных и металлических радиусов компонентов. Ограничение числа реализующихся структурных типов для интерметаллидов связано с тем, что диапазон изменений металлических атомных радиусов существенно уже, чем диапазон изменений радиусов катионов и анионов в ионных соединениях. Вместе с тем среди интерметаллидов, как и среди металлов, имеются специфические кристаллические структуры. Предложенный Л. Полингом метод описания структуры ионных кристаллов с помощью координационных полиэдров используют и для описания структур интерметаллидов. Напр., легко устанавливается родственность интерметаллидов трех структурных типов фаз Лавеса (усеченные тетраэдры) MgCu2, MgZn2 и MgNi2 (рис. 2). В основе наибольшей общей систематики структурных типов интерметаллидов лежат координационные характеристики атома меньшего размера. Всего выделено 14 классов (или семейств) структурных типов, главные из них указаны в табл. 1.
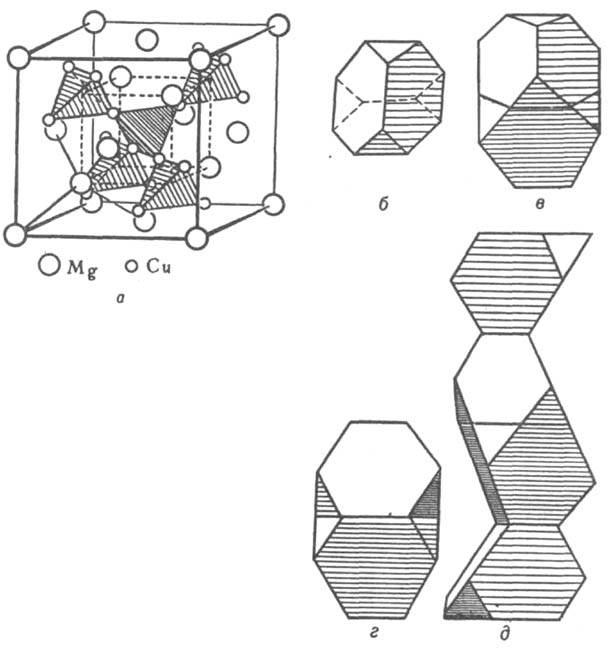
Рис. 2. Структура фаз Лавеса: a - MgCu2. Атомы Mg образуют подрешетку со структурой типа алмаза. Атомы Сu расположены в пустотах (порах) этой подрешетки, образуя тетраэдры (показаны крупной штриховкой); центры этих тетраэдров совпадают с центрами тетраэдрических пор подрешетки атомов Mg. Соединения вершин соседних тетраэдров также образуют тетраэдр (показан мелкой штриховкой); это позволяет представить расположение атомов непрерывной вязью тетраэдров по всему кристаллу, что справедливо для всех типов фаз Лавеса; б - полиэдр Лавеса - усеченный тетраэдр; в, г, д - изображения структурных типов фаз Лавеса в полиэдрах соотв. MgCu2, MgZn2, MgNi2.

Другой подход к систематике кристаллических структур металлов и их сплавов основан на выявлении наиболее характерных плотных и плоских (или почти плоских) сеток и последовательностей их укладки (У. Пирсон, 1972).

Рис. 3. Наиболее распространенные координационные многогранники для интерметаллидов: а - кубооктаэдр, к. ч. = 12 (гранецентрированная кубическая структура); б - гексагональный аналог кубооктаэдра, к. ч. = 12 (гексагональная плотноупакованная структура); в - куб, к. ч. = 8, и октаэдр, к. ч. = 6 (объемноцентрированная кубическая структура). Атом в центре координационного многогранника показан черным кружком, атомы в вершинах - светлыми, принадлежат первой координационной сфере (а, б) или первой и второй (в).
Примерно половина всех известных структурных типов металлических и полупроводниковых соединений описываются укладкой правильных атомных треугольных (36), гексагональных (63) сеток, сеток кагомэ (3636) и сеток (32434), содержащих квадраты (рис. 4; в обозначениях сеток большие цифры указывают форму ячейки, напр. 3 - треугольная, 4 - квадрат и т.д., цифры в верх. индексах - число таких ячеек, окружающих узел сетки).
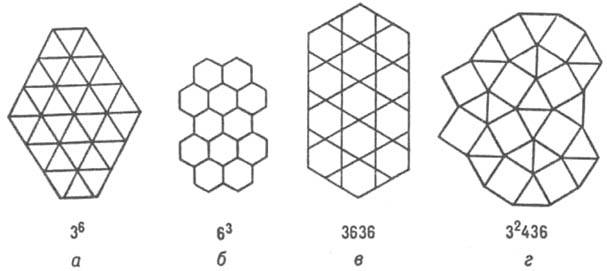
Рис. 4. Структуры интерметаллидов, изображенные атомными сетками.
Несмотря на удобство описания многих структур с помощью плоских атомных сеток, следует учитывать трехмерный характер координации атомов в структурах кристаллов интерметаллидов. Одним из главных принципов структурообразования для этих кристаллов следует считать предложенный Ф. Лавесом в 1967 принцип наиб. полного заполнения пространства, которое обеспечивается или плотнейшей упаковкой сфер при одинаковом радиусе компонентов (к. ч. = 12; поры, или пустоты, между атомами имеют конфигурацию тетраэдров и октаэдров), или идеальной упаковкой нескольких искаженных тетраэдров (характеризуется только одним типом пор - тетраэдрическим).

Рис. 6. Координационные многогранники Каспера - Франка; показаны проекциями атомов на плоскость чертежа; атомы, находящиеся на разных уровнях по отношению к центральному, изображены различными способами.
Свойства. Физические и химические свойства интерметаллидов в гораздо большей степени, чем кристаллическая структура, зависят от природы химической связи. Ионные интерметаллиды обладают свойствами, характерными для солей, -высокой температурой плавления, пониженной (по сравнению с металлической) электрической проводимостью, наличием на диаграммах состояния узких областей гомогенности и др., многие разлагаются водой. Для интерметаллидов с преобладающей металлической связью характерны свойтсва металлов, прежде всего более или менее значительная способность к пластической деформации. Все же многие интерметаллиды отличаются низкой пластичностью и сообщают повышенную хрупкость сплавам, в которых они являются одной из структурных составляющих (напр., фаза -FeCr в хромистых сталях) или основой (напр., SmCo5в сплаве для постоянных магнитов). Применение. Некоторые интерметаллиды используют как магнитные материалы (SmCo5, Fe3Ni, Cu2MnAl и др.), сверхпроводники (Nb3Sn и др.),аккумуляторы Н2 (соед. РЗЭ, РЗЭ и Mg, напр. LaNi5, CeMg12). Интерметаллиды входят в состав высокопрочных конструкционных материалов (напр., обеспечивают высокую прочность в дисперсионно-твердеющих сплавах на основе Al, Cu, Fe и др.), жаропрочных сплавов [напр., в сплавах на основе Ni создает высокодисперсную микроструктуру, сохраняющую высокую прочность в условиях длительной работы при повышенных температурах]. На основе интерметаллидов созданы защитные покрытия из тугоплавких металлов (Ni3Al, Ni3Nb, Ti3Al и др.). Фазовое превращение TiNi (кубическая ромбическая фаза) обусловливает специфическое свойство этого материала - "память формы"; TiNi используют для изготовления термочувствительных элементов и преобразователей тепловой энергии в механическую.
Структуры гидридов
Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом.
 Рассмотрим структуру гидрида алюминия. Гидрид алюминия — AlH3, неорганическое бинарное соединение алюминия с водородом. В нормальных условиях — бесцветное или белое твёрдое вещество, имеющее полимерную структуру: (AlH3)n.
Рассмотрим структуру гидрида алюминия. Гидрид алюминия — AlH3, неорганическое бинарное соединение алюминия с водородом. В нормальных условиях — бесцветное или белое твёрдое вещество, имеющее полимерную структуру: (AlH3)n.
Гидрид алюминия существует в трех модификациях
1) α-(AlH3)n
2) γ-(AlH3)n
3) Al2H6
Рассмотрим молекулярную структуру каждой из модификаций:


Молекулярная структура Ячейка кристаллической Молекулярная структура
гидрида алюминия α-(AlH3)n решетки гидрида алюминия γ-(AlH3)n димера гидрида алюминия
Al2H6
Самой устойчивой является модификация α-(AlH3)n, имеющая гексагональную сингонию(пространственная группа R3c, а = 4,449 Å, b = 4,449 Å, c = 11,804 Å). Длина связи Al—H составляет 1,72 Å, длина связи Al—Al: 3,24 Å. Структура α-(AlH3)n представляет собой совокупность октаэдров АlН6, объединенных шестью трехцентровыми двухэлектронными связями Аl—Н—Аl в кристаллический каркас.
Модификация γ-(AlH3)n существует в ромбической сингонии, пространственная группа Pnnm (а = 5,3806 Å, b = 7,3555 Å, c = 5,77509 Å). Ячейка кристаллической решётки гидрида состоит из двух октаэдров AlH6, длина связи Al—Al составляет 2,606 Å. Особенностью структуры является наличие разветвлённой двойной мостиковой связи Al—2H—Al (длина связи Al—H: 1,68—1,70 Å) в дополнение к обычной связи Al—H—Al (длина связи Al—H: 1,77—1,78 Å). Из-за наличия больших полостей в кристаллической структуре γ-(AlH3)n, данная модификация имеет плотность примерно на 11 % меньше, чем α-(AlH3)n.
При заимодействии распылённых лазером атомов алюминия с водородом при сверхнизких температурах (3,5 K) с последующим ультрафиолетовым излучением и нормализацией при 6,5 K, в продуктах фотолиза можно обнаружить структуры димера Al2H6, аналогичные структуре диборана B2H6. Димер очень неустойчив в конденсированном состояние, поэтому его существование обнаружилось лишь спустя примерно пятьдесят лет после открытия гидрида алюминия.
В 2007 году группа учёных из США воздействовала на алюминий плазменным потоком атомов водорода и обнаружила, что в результате образуются различные анионные полиядерные гидриды алюминия, среди которых особый интерес вызвал анион Al4H6−, чей нейтральный гибрид Al4H6 по расчётам должен отличаться заметной стабильностью. Структурно соединение должно представлять искажённый тетраэдр с вершинами — атомами алюминия, в котором атомы водорода образуют четыре терминальные связи Al–H и две мостиковые связи Al–H–Al. Большой энергетический порог между высшими занятыми и низшими свободными молекулярными орбиталями в сочетании с исключительно высоким значением теплоты сгорания позволяют предположить, что этот гидрид алюминия может представлять собой перспективный материал для ракетного топлива.
Структура галогенидов
Галогениды — соединения галогенов с другими химическими элементами или радикалами. При этом галоген, входящий в соединение, должен быть электроотрицательным; так, оксид брома не является галогенидом. По участвующему в соединении галогену галогениды также называются фторидами, хлоридами, бромидами, иодидами и астатидами. Наиболее известны под этим названием галогениды серебра благодаря массовому распространению плёночной галогеносеребряной фотографии. Соединения галогенов между собой называются интергалогенидами, или межгалоидными соединениями (например, пентафторид иода IF5).
Среди относящихся сюда природных соединений рассмотрим следующие два минерала: флюорит и криолит.
Флюорит - CaF2. "Флюорум" - латинское название элемента F. Синоним: плавиковый шпат. Этот минерал, как и другие богатые фтором минералы, является хорошим флюсом для руд, ускоряя их плавление.

Рис 7. Кристаллическая решетка флюорита
Химический состав: Са 51,2%, F 48,8%. Иногда содержит в виде изоморфной примеси Сl (главным образом желтые разности). Сингония кубическая; гексаоктаэдрический в. с. 3L44L636L29PC. Кристаллическая структура является типической для многих соединений типа АХ2. Она характеризуется двумя координационными числами: для Са-8 и для F-4 (рис. 7). Ионы Са2+ расположены так, как в гранецентрированном кубе (по углам и в центрах граней). Ионы F1- занимают центры всех малых кубов (рис. 135). Облик кристаллов. В пустотах встречается в виде хорошо образованных кубических, реже октаэдрических и додекаэдрических кристаллов. Кристаллы в редких случаях достигают 20-25 см в поперечнике. Грани куба обычно гладкие, а октаэдрические грани-матовые. Иногда грани куба исштрихованы параллельно четырем ребрам или образуют паркетообразный рисунок. Агрегаты. Чаще наблюдается в виде вкраплений и сплошных зернистых, реже землистых, масс (ратовкит).

Рис. 8. Друза кубических кристаллов флюорита
Цвет. Флюорит редко бывает бесцветным и водяно-прозрачным. Большей частью окрашен в различные цвета: желтый, зеленый, голубой, фиолетовый, иногда фиолетово-черный. Любопытно, что окраска исчезает при нагревании, и вновь возвращается при облучении рентгеновскими лучами. В бесцветных кристаллах можно вызвать фиолетовую окраску также действием паров металлического кальция и электрическими разрядами. Это наводит на мысль, что в ряде случаев цвет обусловлен появлением в кристаллической структуре электрически нейтральных атомов Са и F.
Криолит - Na3AlF6. "Криос" по-гречески - лед, "литоc" - камень. Очевидно, назван по сходству со льдом, к которому по блеску и показателю преломления действительно очень близок.
Химический состав. А1 12,8%, Na 32,8%, F 54,4%.

Рис. 9. Кристалл криолита
Сингония моноклинная; призматический в. с. L2PC. Псевдокубический; при температуре около 500° становится кубическим. Облик кристаллов кубовидный (рис. 9). Обычно встречается в сплошных массах, состоящих из крупных неделимых. Бесцветен, но чаще бывает окрашен в серовато-белый, желтоватый или красноватый, изредка черный цвет.