Основная масса разнообразных по составу окислов и гидроокислов сосредоточена в самых верхних частях земной коры-на границе ее с атмосферой, содержащей свободный кислород. Глубина проникновения свободного кислорода в земную кору контролируется в основном уровнем грунтовых вод. Кора выветривания горных пород вместе с зонами окисления рудных месторождений является главной ареной химических реакций, приводящих к новообразованиям, среди которых доминирующую роль играют окислы и гидроокислы металлов.
Особенности кристаллического строения. Почти все относящиеся к данному разделу соединения обладают кристаллическими структурами, для которых характерна ионная связь структурных единиц.
В строении кристаллических решеток из анионов принимают участие: О2- (в окислах) и [ОН]1- (в гидроокислах). Размеры ионных радиусов того и другого примерно одинаковы: 1,32 и 1,33 Å соответственно. Следовательно все разнообразие структур кристаллов находится главным образом в зависимости от размеров катионов, их зарядов и их поляризационных свойств.
В кристаллических структурах этих соединений катионы всегда находятся в окружении анионов кислорода (или гидроксила), и координационные числа кристаллических решеток являются важной характеристикой этих минералов.
Сопоставляя между собой изученные структуры простых окислов, мы можем проследить различные варианты координационных чисел, начиная от довольно высококоординационных ионных решеток и кончая молекулярными, правда редкими, решетками, обладающими низкими числами и вандерваальсовской связью структурных единиц. Окислы двухвалентных металлов, характеризующиеся типичными ионными структурами, кристаллизуются в решетке типа NaCl, т. е. с координационными числами 6 и 6. Лишь окислы сильно поляризующих ионов с 18-электронной наружной оболочкой имеют структуры с более низкой координацией, например ZnO (4 и 4), а также Cu2O (4 и 2). Кристаллические структуры окислов трех- и четырехвалентных металлов, катионы которых имеют меньшие размеры, обладают более низкими координационными числами, падающими в соответствии с приближением ионной связи к гомополярной: А12O3(6 и 4), UO2 (8 и 4), TiO2 (6 и 3), SiO2(4 и 2). В соединениях с молекулярными решетками эти числа еще ниже, например: для Sb2O3 (сенармонтит) - 3 и 2, для СO2 (твердой углекислоты) - 2 и 1.
Что касается сложных окислов, в составе которых участвуют катионы двух различных металлов, то координационные числа для каждого из них могут быть либо одинаковыми, либо различными. Например, для соединения FeTiO3 (ильменит) оба катиона - Fe2+ и Ti4+ находятся в шестерном окружении анионов кислорода, тогда как для соединений типа перовскита (СаТiO3) устанавливается другая картина: катионы Ti4+, Nb6+ и другие находятся в том же шестерном окружении, а катионы Са2+ и Na1+, обладающие большими ионными радиусами, имеют координационное число 12. В соединениях типа шпинели (MgAl2O4) по рентгенометрическим данным устанавливаются следующие координационные числа: для Mg2+ - 4, а для Аl+3 - 6.
Список катионов и их координационные числа в изученных кристаллических структурах простых и сложных окислов приводятся в табл. 2.
| Таблица 2. Главнейшие катионы и их координационные числа в природных окислах | |
| Координационные числа | Катионы |
| Be2+,Mg2+,Fe2+,Mn2+,Ni2+,Zn2+,Cu2+,Si4+ | |
| Mg2+,Fe2+,Mn2+,Al3+,Fe3+,Cr3+,Ti4+,Zr4+,Sn4+,Ta5+,Nb5+ | |
| Zr4+,Th4+,U4+ | |
| Ca2+,Na1+,Y3+,Ce3+,La3+ |
Как известно, вода в природе находится в трех состояниях: твердом (лед, снег), жидком (дождь, минеральные источники, реки, озера, моря и океаны) и газообразном (водяной пар в атмосфере и вулканических эксгаляциях). По своим свойствам вода стоит особняком среди окислов металлов и металлоидов. Вода играет огромную роль в химических процессах, совершающихся в земной коре: химические реакции происходят главным образом в водных растворах. Без воды, так же как и без кислорода, не мыслимо существование и органической жизни на Земле.
Это соединение мы рассмотрим лишь в твердом и жидком состояниях, широко распространенных в природе.
Лед - Н2O. Химический состав. Н 11,2%, 0 88,8%. Иногда содержит газообразные и твердые механические примеси.
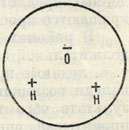
Рис. 10. Строение молекулы Н2O. Протоны Н1+ располагаются внутри иона кислорода
Сингония гексагональная; Кристаллическая структура: лед обладает молекулярной кристаллической структурой с координационным числом 4. Строение самой молекулы Н2O характеризуется следующей особенностью: протоны Н1+,как ионы, не обладающие собственными электронами и имеющие совершенно ничтожные размеры, внедряются глубоко внутрь иона кислорода. Соответственно этому атомное ядро кислорода несколько смещается от центра. Этим и обусловливается дипольный момент в молекуле Н2O. Модель ее упрощенно можно представить в виде тетраэдра, две вершины которого заряжены положительно, а другие две - отрицательно. В силу этого в структуре льда слабо связанные между собой молекулы Н2O ориентированы таким образом, что положительно заряженные участки одних молекул направлены к отрицательно заряженным участкам других молекул. По общему расположению молекул структура льда аналогична структуре вюртцита, с той лишь разницей, что места Zn и S заняты молекулами Н2O. При таком строении (с низким координационным числом, равным 4) получается далеко не плотная упаковка структурных единиц (остаются большие просветы). Этим и объясняется то, что удельный вес льда ниже, чем воды.
Облик кристаллов. Кристаллические образования снежинок, обладающих гексагональной симметрией, чрезвычайно разнообразны по формам шестилучевых фигур роста. Широко известны также дендриты и узорчатые образования льда. В ледяных пещерах кристаллы льда встречаются в виде правильных шестиугольных пластинок, таблитчатых индивидов и сложных по форме сростков.
Агрегаты. В сплошных массах нередко наблюдаются кристаллически-зернистые агрегаты (плотный снег, фирн в ледниковых районах). Глетчерный лед состоит из очень крупных, неправильных по форме кристаллических зерен. Всем хорошо известны также натечные формы сосулек, образующихся из переохлажденной воды на теневой стороне крыш при таянии снега, а также в ледяных пещерах (сталактиты и сталагмиты). В граде, выпадающем из туч в грозовые периоды, нередко можно наблюдать концентрически-слоистое строение. В морозные осенние утра часто образуются выцветы на земле (иней).
Из окислов металлов типа А2O в природных условиях известен лишь один куприт - закись меди (Сu2O). Искусственно в решетке куприта кристаллизуется также Ag2O, не установленная в природе.
Куприт - Cu2O. Название происходит от латинского слова "купрум" - медь. Синоним: красная медная руда. Так называемые кирпичная медная руда (с примесью гидроокислов железа) и смоляная медная руда (с примесью кремнезема и гидроокислов железа) являются по существу коллоидальными минеральными смесями.
Химический состав. Сu 88,8%, О 11,2%. Очень часто устанавливается в качестве механической примеси самородная медь, а в скрытокристаллических разностях-Fe2O3, SiO2 и Н2O.
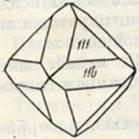
Рис. 11. Кристалл куприта
Сингония кубическая; пентагон - триоктаэдрический в. с. 3L44L36L2. Облик кристаллов октаэдрический (рис. 144), реже кубический или додекаэдрический. Кристаллы обычно мелки. Изредка наблюдаются игольчатые или волосистые индивиды. Чаще встречается в сплошных зернистых, иногда в землистых (в смеси с посторонними примесями) агрегатах.
Цвет куприта красный до свинцово-серого (в тонкозернистых или скрытокристаллических агрегатах.) Черта коричнево-красная или буровато-красная (при растирании вторым бисквитом желтеет). Блеск кристаллов в изломе алмазный. В тонких осколках куприт полупрозрачен.
Халькогениды. Халькогениды — бинарные химические соединения элементов шестой группы периодической системы (халькогенов, к которым относятся кислород, сера, селен, теллур, полоний и ливерморий) с металлами.
В системе As-S известны сульфиды As2S5, As2S3 (в природе - минерал аурипигмент), As4S4 (минерал реальгар) и As4S3 (минерал диморфит); в системе As-Se - селениды As2Se3 и As4Se4; в системе As-Te известен один теллурид - Аs2Те3. Структура и свойства мышьяка халькогенидов приведены в табл. 3. Халькогениды мышьяка устойчивы на воздухе, не растворимы в воде, хорошо растворимы в растворах щелочей, при нагревании -в HNO3. Обладают полупроводниковыми свойствами, прозрачны в ИК области спектра.
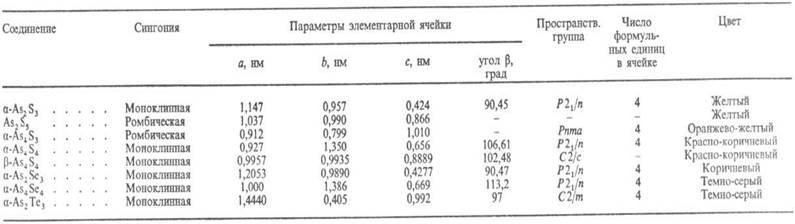 Табл.3. ХАРАКТЕРИСТИКА КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ ХАЛЬКОГЕНИДОВ МЫШЬЯКА
Табл.3. ХАРАКТЕРИСТИКА КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ ХАЛЬКОГЕНИДОВ МЫШЬЯКА
Стекла мышьяка халькогенидов - полупроводниковые материалы, используемые в электронике, оптике, бессеребряной фотографии, электрофотографии, запоминающих устройствах. Халькогениды мышьяка применяют для изготовления волоконных световодов для ИК области спектра; реальгар также компонент пиротехнических смесей, добавка при литье дроби, его используют для удаления волос с кож; аурипигмент и реальгар - пигменты, применяемые для приготовления красок для живописи.
5. Структуры CdI2 и CdCl2
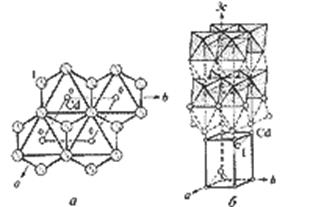
Кристаллическая структура двухслойной модификации CdI2 (брусита Mg(OH)2)
|
| Рис. 12 |
В основе кристаллической структуры одной из модификаций CdI2 лежит двухслойная плотнейшая упаковка из ионов I-, где катионы Cd2+ заполняют послойно половину октаэдрических пустот (рис. 12, а). Это снижает симметрию всей структуры от голоэдрической группы 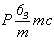 до гемиэдрической подгруппы
до гемиэдрической подгруппы 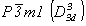 , так как исчезает горизонтальная плоскость mz, а следовательно, и вертикальная составляющая оси 63 - винтовая ось 2-го порядка - при сохранении центров инверсии. В связи с этим отсутствует одна из двух систем вертикальных плоскостей симметрии - плоскости с - и соответственно одна из двух систем горизонтальных осей 2-го порядка. И несмотря на то что симметрия инвариантных позиций
, так как исчезает горизонтальная плоскость mz, а следовательно, и вертикальная составляющая оси 63 - винтовая ось 2-го порядка - при сохранении центров инверсии. В связи с этим отсутствует одна из двух систем вертикальных плоскостей симметрии - плоскости с - и соответственно одна из двух систем горизонтальных осей 2-го порядка. И несмотря на то что симметрия инвариантных позиций 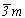 катионов Cd по сравнению с позициями Ni в структуре NiAs не изменилась, кратность их уменьшилась вдвое. Симметрия же позиций анионов понизилась от инвариантной группы
катионов Cd по сравнению с позициями Ni в структуре NiAs не изменилась, кратность их уменьшилась вдвое. Симметрия же позиций анионов понизилась от инвариантной группы 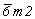 до моновариантной 3m за счет отсутствия в структуре горизонтальной плоскости симметрии, а следовательно, и фиксирующей эту позицию особой точки
до моновариантной 3m за счет отсутствия в структуре горизонтальной плоскости симметрии, а следовательно, и фиксирующей эту позицию особой точки 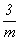 .
.
В полиэдрическом исполнении модель двухслойной модификации CdI2 (рис. 12, б) будет представлена слоями из двух типов октаэдров, различный "цвет" которых укажет на чередование вдоль тройной оси структуры заселенных октаэдрических слоев с пустыми. Наличие в такой модели равного количества двух сортов октаэдров - с катионной "начинкой" и без нее - делает возможным описание полиэдрической модели структуры с позиций антисимметрии - черно-белой симметрии. Добавление к классической подгруппе  горизонтальной плоскости антисимметрии - "цветной" плоскости m', связывающей заполненные (черные) и пустые (белые) октаэдры двух слоев кристаллической структуры CdI2, - приводит к появлению не только вертикальной цветной составляющей оси 63 = 3 . 21. (
горизонтальной плоскости антисимметрии - "цветной" плоскости m', связывающей заполненные (черные) и пустые (белые) октаэдры двух слоев кристаллической структуры CdI2, - приводит к появлению не только вертикальной цветной составляющей оси 63 = 3 . 21. (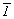 . m' z = 2' 1), но и остальных цветных элементов симметрии шубниковской группы
. m' z = 2' 1), но и остальных цветных элементов симметрии шубниковской группы 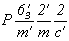 , так как взаимодействия mv . mz ' и 2z'. mv дадут цветные элементы симметрии 2' коорд и с' апоф соответственно.
, так как взаимодействия mv . mz ' и 2z'. mv дадут цветные элементы симметрии 2' коорд и с' апоф соответственно.
Слоистых структур с общей формулой АХ2, построенных на основе двухслойной плотнейшей упаковки, довольно много. Среди них Mg(OH)2, Mn(OH)2, SrS2, PtS2 и др.
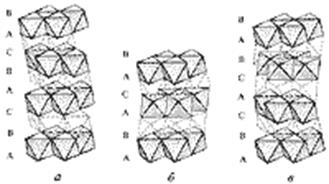
Кристаллическая структура трехслойной модификации CdCl2
|
| Рис. 13 |
Поскольку в основе кристаллической структуры трехслойной модификации CdCl2 (рис. 13,а) лежит трехслойная плотнейшая упаковка из атомов хлора, то можно было бы ожидать кубическую симметрию, т.е. характерную для этой упаковки пр. гр. 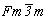 . Однако послойное заполнение половины октаэдрических пустот катионами Cd (слои перпендикулярны одной из систем осей 3-го порядка кубической плотнейшей упаковки) оставляет лишь одну систему осей 3-го порядка, что снижает симметрию всей структуры до гексагональной. При этом исчезают все координатные и половина диагональных плоскостей симметрии исходной кубической пространственной группы. Наличие трех уровней расположения катионов Cd позволяет предположить и затем легко найти косые трансляционные векторы гексагональной ромбоэдрической элементарной ячейки
. Однако послойное заполнение половины октаэдрических пустот катионами Cd (слои перпендикулярны одной из систем осей 3-го порядка кубической плотнейшей упаковки) оставляет лишь одну систему осей 3-го порядка, что снижает симметрию всей структуры до гексагональной. При этом исчезают все координатные и половина диагональных плоскостей симметрии исходной кубической пространственной группы. Наличие трех уровней расположения катионов Cd позволяет предположить и затем легко найти косые трансляционные векторы гексагональной ромбоэдрической элементарной ячейки 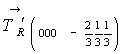 и
и 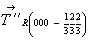 ,подтвердив их присутствие расположением ионов Cl. В результате приходим к пр. гр.
,подтвердив их присутствие расположением ионов Cl. В результате приходим к пр. гр. 
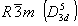 .
.
В шубниковской группе  , описывающей симметрию полиэдрической модели трехслойной модификации СdCl2 (рис. 13, а) с позиций антисимметрии, появляется недостающая половина центров инверсии (на буквах "к"), но уже в качестве цветных элементов симметрии. Описанное чередование вдоль тройной оси классических и цветных элементов симметрии указывает на присутствие в структуре цветной трансляции
, описывающей симметрию полиэдрической модели трехслойной модификации СdCl2 (рис. 13, а) с позиций антисимметрии, появляется недостающая половина центров инверсии (на буквах "к"), но уже в качестве цветных элементов симметрии. Описанное чередование вдоль тройной оси классических и цветных элементов симметрии указывает на присутствие в структуре цветной трансляции 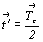 , направленной в середину вертикального ребра гексагональной дважды центрированной ячейки Браве. При этом классические центры инверсии находятся в центре каждого заселенного и пустого октаэдра, центры же инверсии антисимметрии - на стыках двух троек октаэдров: заселенных сверху и пустых снизу. Цветная вертикальная трансляция
, направленной в середину вертикального ребра гексагональной дважды центрированной ячейки Браве. При этом классические центры инверсии находятся в центре каждого заселенного и пустого октаэдра, центры же инверсии антисимметрии - на стыках двух троек октаэдров: заселенных сверху и пустых снизу. Цветная вертикальная трансляция  обусловливает и чередование в этом направлении горизонтальных цветных и обычных осей 2-го порядка - 2 (2').
обусловливает и чередование в этом направлении горизонтальных цветных и обычных осей 2-го порядка - 2 (2').
Аналогичное "возвращение" потерянных элементов симметрии можно наблюдать и при описании структуры четырехслойной модификации СdI2 (рис. 13, б), где "топазовая" матрица из ионов йода также послойно заполнена катионами Cd:

 .
.
При этом симметрия чистой четырехслойной плотнейшей упаковки - пр. гр.  - понижается за счет послойного внедрения атомов Cd до своей гемиморфной подгруппы Р63mc (параметр с при этом остается прежним) и возвращается в полиэдрическую модель этой структуры вновь, но уже в качестве шубниковской группы симметрии -
- понижается за счет послойного внедрения атомов Cd до своей гемиморфной подгруппы Р63mc (параметр с при этом остается прежним) и возвращается в полиэдрическую модель этой структуры вновь, но уже в качестве шубниковской группы симметрии -  .
.
Тот же процесс возвращения утерянных элементов симметрии прослеживается и в структуре шестислойной - "рамзаитовой" - модификации CdI2, в полиэдрическом изображении которой (рис. 13, в) появление цветной горизонтальной плоскости симметрии вновь приводит к голоэдрической, но уже шубниковской группе симметрии:
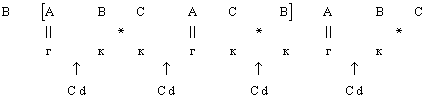
6. Бинарные соединения и структура в α-Al2O3
Бинарные соединения — химические вещества, образованные, как правило, двумя химическими элементами. Термин «бинарные соединения» обычно не применяется в отношении основных и кислотных оксидов. При этом несолеобразующие оксиды включают в бинарные соединения. Многоэлементные вещества, в формульной единице которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения.
Бинарные соединения, несмотря на кажущуюся простоту их химического состава, представляют собой следующий после простых веществ принципиально важный объект изучения природы вещества. С химической точки зрения, этот класс веществ обладает и качественно иными характеристиками, с которыми не приходится сталкиваться при изучении простых веществ. Во-первых, помимо внешних факторов, влияющих на состояние и свойства вещества (температура и давление), здесь появляется и внутренний фактор — состав, и связанная с ним проблема постоянства и переменности состава, имеющая фундаментальное значение в химии. Во-вторых, при описании бинарных соединений впервые формируются такие базисные понятия, как валентность, степень окисления, поляризация химической связи. Здесь, в отличие от простых веществ, появляются гетерополярная составляющая химической связи и все эффекты, связанные с разностью электроотрицательностей компонентов.
Исключительно важную роль играют бинарные соединения с классификационной точки зрения. Многие из них относятся и к так называемым характеристическим соединениям, отражающим типичные степени окисления и их сравнительную стабильность. К таким соединениям относятся прежде всего оксиды, летучие водородные соединения, а также галогениды.
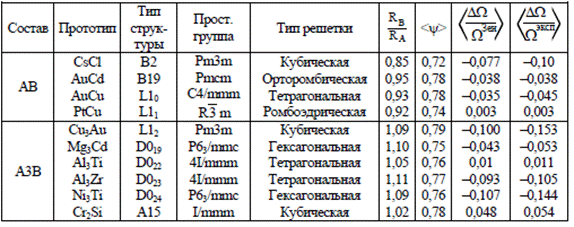
На рисунке представлены элементарные ячейки структур бинарных сплавов простых стехиометрических соотношений АВ и А3В. Важно отметить, что рассматриваются плотноупакованные структуры

Список использованной литературы
1. Белов Н. В., Структура ионных кристаллов и металлических фаз, М., 1947;
2. Теслюк М. Ю., Металлические соединения со структурами фаз Лавеса, М., 1969;
3. Интерметаллические соединения, сб. под ред. И. И. Корнилова, пер. с англ., М., 1970;
4. Дегтярева В. Ф., Скаков Ю. А., "Кристаллография", 1976, т. 21, в. 2, с. 405-07;
5. Пирсон У. Б., Кристаллохимия и физика металлов и сплавов, ч. 1-2, пер. с англ., М., 1977;
6. Уманский Я. С., Скаков Ю. А., Физика металлов (Атомное строение металлов и сплавов), М., 1978;
7. Николин Б.И., Многослойные структуры и политинизм в металлических сплавах, К., 1984. Ю. А. Скаков.
8. Антонова М.М., Морозова Р.А. Препаративная химия гидридов. — Киев: «Наукова Думка», 1976. — С. 65—68.
9. Семененко К.Н., Булычев Б.М., Шевлягина Е.А. Гидрид алюминия // Успехи химии. — 1966. — Т. 35. — № 9. — С. 1529—1548.
10. Бетехтин А.Г. 'Курс минералогии' - Москва: Государственное издательство геологической литературы, 1951 - с.543