Пример 1. С какой деполяризацией будет протекать коррозия никеля во влажном воздухе (рН = 7) при Т = 298 К. Напишите уравнения электродных процессов и суммарной реакции коррозии. Составьте схему коррозионного гальванического элемента.
Решение. Рассчитаем потенциалы водородного и кислородного электродов:
 = – 0,059×рН =
= – 0,059×рН =  = – 0,413 В
= – 0,413 В
 = 1,213 – 0,059×рН = 1,213 – 0,059×7 = 0,8 В.
= 1,213 – 0,059×рН = 1,213 – 0,059×7 = 0,8 В.
Сравним потенциалы этих электродов со стандартным потенциалом никеля  =–0,23 В.
=–0,23 В.
Так как потенциал  больше потенциала водородного электрода, то коррозия с водородной деполяризацией невозможна, но возможна с кислородной деполяризацией, т.к. потенциал никелевого электрода –0,23 В меньше потенциала кислородного электрода
больше потенциала водородного электрода, то коррозия с водородной деполяризацией невозможна, но возможна с кислородной деполяризацией, т.к. потенциал никелевого электрода –0,23 В меньше потенциала кислородного электрода  , равный 0,8 В.
, равный 0,8 В.
Электродные процессы, протекающие на поверхности никеля:
А(–): Ni: Ni - 2е  Ni2+ | x 2
Ni2+ | x 2
К(+): Ni: O2 + 2Н2O + 4е  4ОН
4ОН  -
-
Суммарная реакция: 2Ni + O2 +2Н2О  2 Ni2+ + 4ОH
2 Ni2+ + 4ОH 
Побочная реакция: 2 Ni2+ + 4ОН 
 2Ni(OH)2
2Ni(OH)2 
Побочные реакции протекают в тех случаях, когда продукты анодной (Меz+) и катодной реакций образуют труднорастворимые соединения, в основном, гидроксиды металлов.
Схема_коррозионного Г.Э.
(A) Ni  (A) Ni
(A) Ni
В cплавах или при контакте металловсначаланеобходимо определить, какой из металлов будет анодом, для чего сравниваем  металлов.
металлов.
Например, в cплаве Fе–Со  = – 0,44В <
= – 0,44В <  = –0,277 В, следовательно, анодом будет железо. Прикоррозии сплава железо будет анодно растворяться, а на кобальте будут протекать катодные процессы.
= –0,277 В, следовательно, анодом будет железо. Прикоррозии сплава железо будет анодно растворяться, а на кобальте будут протекать катодные процессы.
Пример 2. Составьте уравнения электродных процессов, происходящих при коррозии медно-цинкового сплава в растворе кислоты при рН = 3иT = 298 К.
Решение. Сравним стандартные потенциалы металлов:  =+ 0,З37 В и
=+ 0,З37 В и  = – 0,763 В. Следовательно, анодом будет цинк, катодом - медь.
= – 0,763 В. Следовательно, анодом будет цинк, катодом - медь.
Рассчитаем потенциалы водородного и кислородного электродов:
 = –0,059×pH=
= –0,059×pH=  = – 0,177 В
= – 0,177 В
 =1,213-0,059×рН =1,213 -
=1,213-0,059×рН =1,213 - 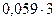 =1,036 В
=1,036 В
Чтобы определить с какой деполяризацией будет протекать коррозия, сравним  с потенциалами окислителей:
с потенциалами окислителей:
 <
< 
 <
< 
Следовательно, коррозия сплава возможна и будет протекать со смешанной (кислородной и водородной) деполяризацией.
Электродные процессы:
А(–): «Zn»: Zn – 2 e –  Zn2+| x3
Zn2+| x3
К(+): «Сu»: 2Н+ + 2 е – 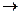 Н2 – водородная деполяризация
Н2 – водородная деполяризация
 – кислородная деполяризация
– кислородная деполяризация
Схема коррозионного гальванического элемента: НС1, рН = 3
(А)Zn  Cu(K)
Cu(K)
Основные методы защиты металлов от коррозии
Одним из основных способов является нанесение защитных покрытий на изделия. Защитные покрытия - слои, искусственно создаваемые на поверхности металлических изделий для предохранения их от коррозии.
Защитные покрытия делятся на неметаллические неорганические (оксидные, фосфатные, хроматные), неметаллические органические (лакокрасочные и полимерные) и металлические покрытия. Покрытия неметаллические неорганические и органические механически защищают металлы от коррозии, изолируя их от контакта с внешней средой.
Металлические покрытия по характеру защитного действия делятся на анодные и катодные.
Анодным, называется покрытие, стандартный потенциал которого меньше, чем у защищаемого металла. При нарушении слоя анодного покрытия возникают коррозионные гальванопары, в которых металл покрытия играет роль анода и корродирует, а на защищаемом металле - катоде - восстанавливается окислитель.
Например, для железа  = – 0,44 В анодными будут покрытия,
= – 0,44 В анодными будут покрытия,
цинк  = – 0,76 В, хром
= – 0,76 В, хром  =–0,71 В
=–0,71 В
Катодным называется покрытие, стандартный потенциал которого больше, чем у защищаемого металла. При нарушении катодного покрытия образуется гальванический элемент, в котором металлическое покрытие будет катодом, а защищаемый металл - анодом.
Например, катодными покрытиями для меди  + 0,337 В могут быть,
+ 0,337 В могут быть,
серебро  = +0,799 В, золото
= +0,799 В, золото  = +1,68 В.
= +1,68 В.
Протекторная защита. К изделию присоединяют металл или сплав, потенциал которого значительно меньше потенциала изделия. Такие металлы или сплавы называются протекторами, чаще всего это А1, Мg, Zn. В коррозионной среде металл протектора растворяется, а на защищаемом металле протекают катодные процессы.
Пример 3. Подберите протектор для защиты изделия из сплава Sn-Рb от коррозии в водном растворе (рН = 1). Составьте уравнения процессов коррозии.
Решение. Поскольку  = –0,14 В <
= –0,14 В < 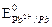 = –0,126 В, то анодом при коррозии будет олово. Следовательно, потенциал протектора должен быть меньше потенциала олова, например, выбираем в качестве протектора марганец
= –0,126 В, то анодом при коррозии будет олово. Следовательно, потенциал протектора должен быть меньше потенциала олова, например, выбираем в качестве протектора марганец  = –1,18 В <
= –1,18 В <  . Следовательно, анодом теперь будет протектор – Мn, а на сплаве будут протекать катодные процессы.
. Следовательно, анодом теперь будет протектор – Мn, а на сплаве будут протекать катодные процессы.
Рассчитаем потенциалы водородного и кислородного электродов:
 = –0,059 рН = –
= –0,059 рН = –  = – 0,059 В
= – 0,059 В
 = 1,213–
= 1,213–  = 1,154 В.
= 1,154 В.
Поскольку  <
<  <
<  , то процесс коррозии будет протекать с водородной и кислородной деполяризацией.
, то процесс коррозии будет протекать с водородной и кислородной деполяризацией.
Электродные процессы:
А(–): «Мn»: Мn – 2 е – 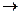 Мn2+ | х 3
Мn2+ | х 3
К(+): «Sn-Рb»: 2Н+ + 2 е – 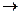 Н2 – водородная деполяризация
Н2 – водородная деполяризация
O2 + 4Н+ +4 е –  2 Н2О – кислородная деполяризация
2 Н2О – кислородная деполяризация
Суммарный процесс: 3 Мn + 6Н+ + O2  3 Мn2+ = Н 2 + 2 Н 2 О
3 Мn2+ = Н 2 + 2 Н 2 О