Состояние молекул, находящихся в поверхностном слое, существенно отличается от состояния молекул в глубине жидкости. Рассмотрим простой случай – жидкость – пар (рис. 2).
 Рис.2. Действие межмолекулярных сил на поверхности раздела и внутри жидкости
Рис.2. Действие межмолекулярных сил на поверхности раздела и внутри жидкости
На рис. 2 молекула (а) находится внутри жидкости, молекула (б) – в поверхностном слое. Сферы вокруг них – расстояния, на которые распространяются силы межмолекулярного притяжения окружающих молекул.
На молекулу (а) равномерно действуют межмолекулярные силы со стороны окружающих молекул, поэтому силы межмолекулярного взаимодействия компенсируются, равнодействующая этих сил равна нулю (f=0).
Плотность пара значительно меньше плотности жидкости, так как молекулы удалены друг от друга на большие расстояния. Поэтому молекулы, находящиеся в поверхностном слое, почти не испытывают силы притяжения со стороны этих молекул. Равнодействующая всех этих сил будет направлена внутрь жидкости перпендикулярно ее поверхности. Таким образом, поверхностные молекулы жидкости всегда находятся под действием силы, стремящейся втянуть их внутрь и, тем самым, сократить поверхность жидкости.
Чтобы увеличить поверхность раздела жидкости, необходимо затратить работу А (Дж). Работа, необходимая для увеличения поверхности раздела S на 1 м2, 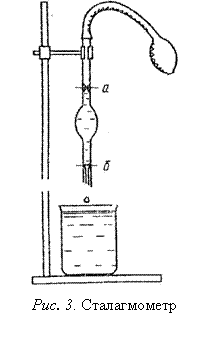 является мерой поверхностной энергии или поверхностным натяжением.
является мерой поверхностной энергии или поверхностным натяжением.
Таким образом, поверхностное натяжение δ (Дж/м2 = Н*м/м2 = Н/м) – результат некомпенсированности межмолекулярных сил в поверхностном слое:
δ = F/S (F – поверхностная энергия) (3)
Существует большое число методов определения поверхностного натяжения. Наиболее распространены сталагмометрический метод (метод счета капель) и метод наибольшего давления газовых пузырьков.
Сталагмометр (рис.3) представляет собой толстостенную капиллярную трубку с расширением посередине; выше и ниже расширения находятся две метки (а и б), ограничивающие определенный объем. Нижняя часть сталагмометра заканчивается капилляром с отшлифованной поверхностью. Метод заключается в определении массы капли, вытекающей из капилляра. В момент отрыва масса капли преодолевает силу поверхностного натяжения, которое удерживает каплю на конце трубки. Чем больше капля, тем больше поверхностное натяжение.
Экспериментальные исследования влияния различных веществ на поверхностное натяжение растворов показали, что в зависимости от природы растворенного вещества и растворителя возможно как падение, так и повышение поверхностного натяжения с ростом концентрации растворов.
1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными вещества (ПАВ). По отношению к водным растворам поверхностно-активными веществами являются спирты, жирные кислоты и их соли (мыла), сложные эфиры, амины, белки и некоторые другие вещества, имеющие дифильное строение. В молекулах таких веществ различают неполярную (гидрофобную) часть – углеводородный радикал («хвост») и полярную (гидрофильную) часть. Молекулу ПАВ принято изображать следующей схемой:

Прямая линия символизирует неполярную часть - углеводородный радикал («хвост»), а кружок – полярную группу. Чтобы вещество обладало способностью понижать поверхностное натяжение растворителя, необходимо, чтобы в составе молекулы имелись полярные группы: -ОН, -NH2, -COOH, -SO3 др. Поверхностно-активными по отношению к воде являются вещества менее полярные, чем вода (так, дипольный момент воды равен 1,84 Д, а у этанола – 1,70 Д). Такие вещества взаимодействуют с водой намного слабее, чем молекулы воды друг с другом. Поэтому, попадая на поверхность, они уменьшают поверхностное натяжение.
ПАВ, как и все вещества в зависимости от способности к электролитической диссоциации, делят на электролиты (ионогенные ПАВ) и неэлектролиты (неионогенные ПАВ). Ионогенные ПАВ подразделяют на катионные, анионные и амфотерные
2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К этим веществам относятся сильные электролиты: соли, кислоты, щѐлочи. Ионы этих веществ, образующиеся в результате электролитической диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды внутрь объѐма раствора. Однако некоторые немногие оставшиеся на поверхности создают вблизи поверхности силовое поле, тем самым повышают поверхностное натяжение.
3. Имеются вещества, которые не меняют поверхностное натяжение растворителя. Эти вещества называют поверхностно-неактивными. Молекулы таких веществ в своѐм составе имеют большое число полярных функциональных групп (например, сахароза).
При помощи методов рентгеноструктурного анализа было установлено, что в жидкостях есть некоторая упорядоченность пространственного расположения молекул в отдельных микрообъемах. Вблизи каждой молекулы наблюдается так называемый ближний порядок. При удалении от нее на некоторое расстояние эта закономерность нарушается. И во всем объеме жидкости порядка в расположении частиц нет.
Вязкость η (Па·с) – свойство оказывать сопротивление перемещению одной части жидкости относительно другой. В практической жизни человек сталкивается с большим множеством жидких систем, вязкость которых различна, – вода, молоко, растительные масла, сметана, мед, соки, патока и т. д.
 Вязкость жидкостей обусловлена межмолекулярным воздействием, ограничивающим подвижность молекул. Она зависит от природы жидкости, температуры, давления.
Вязкость жидкостей обусловлена межмолекулярным воздействием, ограничивающим подвижность молекул. Она зависит от природы жидкости, температуры, давления.
Для измерения вязкости служат приборы, называемые вискозиметрами. Выбор вискозиметра и метода определения вязкости зависит от состояния исследуемой системы и ее концентрации.
Для жидкостей с малой величиной вязкости или небольшой концентрацией широко используют вискозиметры капиллярного типа (рис.4).