Окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока от внешнего источника через раствор или расплав электролита, носит название электролиза.
Электролиз проводят в электролизерах или электролитических ваннах, заполненных раствором или расплавом электролита.
Электрод, подсоединенный к отрицательному полюсу внешнего источника тока, называется катодом. На катоде протекают процессы восстановления частиц электролита.
Электрод, подключенный к положительному полюсу источника тока, называется анодом. На аноде протекают процессы окисления частиц электролита или материала электрода.
Последовательность процессов, протекающих на электродах, определяются свойствами электролита, растворителя и материала электрода. Какие именно процессы будут протекать, прежде всего зависит от соотношения электродных потенциалов соответствующих реакций. Из нескольких альтернативных процессов протекает тот, осуществление которого требует минимальных затрат энергии. Это означает, что на катоде в первую очередь протекают реакции с наибольшим значением электродного потенциала, а на аноде - с наименьшим.
Рассматривая процессы электролиза водных растворов, необходимо учитывать возможность участия молекул воды в электродных реакциях: восстановления на катоде (1) и окисления на аноде (2).
На катоде: 2H2O + 2e → H2 + 2 OH- (1)
На аноде: 2H2O – 4 e 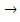 O2 + 4 H+ (2)
O2 + 4 H+ (2)
Анодные процессы зависят от природы электролита и материала анода. В связи с этим различают электролиз с инертным и растворимым анодом.
Инертным (нерастворимым) называется анод, материал которого не окисляется в процессе электролиза. К инертным относятся графитовый, угольный, платиновый и др. электроды.
Растворимым является анод, материал которого окисляется при прохождении тока. Большинство металлических электродов являются растворимыми. В случае растворимого анода, кроме окисления аниона электролита и молекул воды, возможна реакция окисления материала анода.
Катодные процессы:
Как протекает восстановление на катоде в водных растворах, можно определить с помощью ряда стандартных электродных потенциалов (см. таблицу).
Здесь возможны три случая:
1. Катионы металлов, имеющих стандартный электродный потенциал, больший, чем у водорода (от Cu2+ до Au3+ включительно), при электролизе практически полностью восстанавливаются на катоде.
2. Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до Al3+ включительно), не восстанавливаются на катоде, вместо них восстанавливаются молекулы воды.
3. Катионы металлов, имеющих стандартный электродный потенциал, меньший, чем у водорода, но больший, чем у алюминия (от Al3+ до 2Н+), при
электролизе на катоде восстанавливаются одновременно с молекулами воды.
Если же водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения
стандартного электродного потенциала соответствующего металла. Так, из смеси катионов Ag+, Cu2+, Fe2+ сначала будут восстанавливаться катионы серебра (Е0 = +0.80 В), затем катионы меди (Е0 = +0.34 В) и последними – катионы железа ((Е0 = - 0.44 В).
Анодные процессы:
Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод.
На нерастворимом аноде (уголь, графит, платина, иридий) в процессе электролиза происходит окисление анионов и молекул воды. При этом анионы бескислородных кислот (например, S2-, J-, Br-, Cl-) при их достаточной концентрации легко окисляются. Если же раствор содержит анионы кислородных кислот (например, SO42-, NO3-, CO32-, PO43-), то на аноде окисляются не эти ионы, а молекулы воды.
Растворимый анод при электролизе окисляется, т.е. посылает электроны во внешнюю цепь. При отдаче электронов смещается равновесие между электродом и раствором
Ме «Меn+ + ne-
металл уходят уходят во
анода в раствор внешнюю цепь
и анод растворяется.
Напряжение электролиза. Напряжение электролиза (Δ U эл-за) – это разность потенциалов, необходимая для протекания реакций на катоде и аноде.
Δ U эл-за = iE а – iE к + Δ U эл-та + iR, (3)
где iE а, iE к - потенциалы анода и катода под током соответственно, Δ U эл-та, iR – падение напряжения при прохождении тока через электролит и внешнюю цепь соответственно.
Электролиз процесс неравновесный, поэтому потенциалы электродных реакций под током отличаются от своих равновесных значений на величину Δ Е а и Δ Е к .
iE а = рE а + ΔЕа, iEк = р E к + Δ Е к. (4)
Смещение потенциала электрода от его равновесного значения под влиянием внешнего тока называется электродной поляризацией. Величина поляризации (Δ Е а и Δ Е к) называется перенапряжением.
Сравнение равновесных потенциалов конкурирующих электродных реакций может служить только ориентировочным критерием оценки последовательности разряда частиц при электролизе. Прохождение тока нарушает равновесие, существующее на электродах.
Большинство процессов на электродах идут с перенапряжением. На величину перенапряжения влияют многие факторы: природа материала электрода, условия проведения электролиза (плотность тока, температура) и др. Для правильного выбора процессов на электродах необходимо сравнивать не величины равновесных потенциалов возможных полуреакций, а величины потенциалов поляризованных электродов.
Процесс образования газов, как правило, протекает с перенапряжением. Рассмотрим процесс электролиза водного раствора хлорида на инертном электроде. На аноде возможны следующие реакции:
2 Cl- - 2 e → Cl2 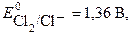
2H2O – 4 e 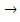 O2 + 4 H+
O2 + 4 H+ 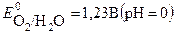
Потенциал окисления воды дан для кислого раствора (рН=0), с учетом подкисления раствора при электролизе.
Согласно величинам стандартных электродных потенциалов на аноде должен выделяться кислород. В действительности на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода составляет 1,17 В при плотности тока = 1а/м2, что повышает потенциал окисления воды до 2,4 В.
I закон Фарадея.
Для любого электродного процесса количество вещества, испытывающего превращение в данном электродном процессе, прямо пропорционально количеству электричества, прошедшему через раствор (расплав) электролита.
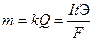 , (12)
, (12)
где k – электрохимический эквивалент, г/Кл или г/А•ч,
Q – количество электричества, Кулон,
F = 96500 Кл/моль (А•с/моль) = 26,8 А•ч/моль – постоянная Фарадея.
II закон Фарадея
При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам:
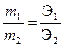 ,
,
где m 1 и m 2 – массы веществ 1 и 2,Э1 и Э2, г/моль – эквивалентные массы веществ 1 и 2.
На практике часто вследствие протекания параллельных окислительно- восстановительных процессов на электродах образуется меньше вещества, чем соответствует прошедшему через раствор электричеству, согласно I закону Фарадея.
Для характеристики потерь электричества при электролизе введено понятие «Выход по току». Выходом по току Вт называется выраженное в процентах отношение количества, фактически полученного продукта электролиза m факт. к теоретически рассчитанному m теор, соответствующему количеству прошедшего электричества: 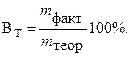
ПРИМЕРЫРЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
ПРИМЕР 1. Какие процессы будут протекать при электролизе водного раствора сульфата натрия с угольным анодом? Какие процессы изменятся, если угольный электрод заменить на медный?
Решение: в растворе сульфата натрия в электродных процессах могут участвовать ионы натрия Na+, SO42- и молекулы воды. Угольные электроды относятся к инертным.
На катоде возможны следующие процессы восстановления:
Na+ + e → Na 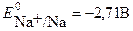
2H2O + 2e → H2 + 2 OH- 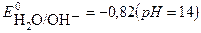
Потенциал восстановления молекул воды (-0,82В) дан для щелочного раствора, с учетом подщелачивания среды в ходе электролиза. Сравнивая потенциалы катодных реакций, видим, что потенциал восстановления воды наибольший, что соответствует их большей окислительной способности. Поэтому на катоде будет происходить восстановление молекул воды, сопровождающееся выделением водорода и образованием в катодном пространстве гидроксид ионов ОН-. Ионы натрия Na+, приходящие к катоду, будут накапливаться у электрода.
На аноде возможны следующие реакции:
2 SO42- - 2e → S2O82- 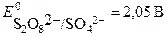
2 H2O - 4 e → 4H+ + O2 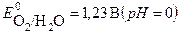 .
.
Окисление молекул воды идет при меньшем потенциале, следовательно, они обладают большей восстановительной способностью. Поэтому на аноде будет происходить окисление молекул воды с выделением кислорода и образованием кислой среды (ионов водорода Н+). Ионы SO42- будут накапливаться в анодном пространстве.
Таким образом, при электролизе раствора сульфата натрия с угольным инертным анодом в электродных процессах участвуют только молекулы воды. В близи катода ионы Na+ и OH- образуют раствор щелочи NaOH, а у анода ионы H+ и SO42- – раствор серной кислоты. Суммарная реакция электролиза выражается уравнением:
2 Na2SO4 + 6H2O = 2H2 + 4 NaOH + O2 + 2H2SO4.
у катода у анода
При замене инертного (угольного) анода на медный, на аноде становиться возможным протекание еще одной реакции окисления – растворение меди:
Cu – 2 e → Cu2+ 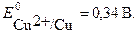
Этот процесс характеризуется меньшим значением потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе Na2SO4 с медным анодом на аноде пройдет окисление меди, а в анодном пространстве будет накапливаться сульфат меди CuSO4. Cуммарное уравнение реакции электролиза выразится уравнением:
Na2SO4 + 2H2O + Cu = H2 + 2 NaOH + CuSO4.
у катода у анода
ПРИМЕР 2. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида никеля NiCl2 с инертным анодом.
Решение: на катоде возможны следующие реакции:
Ni2+ + 2e → Ni 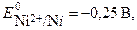
2H2O + 2e → H2 + 2 OH- 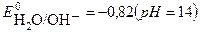 . Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
. Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
Большинство процессов при электролизе идет с перенапряжением, особенно образование газов (H2, O2 и др.). Пренебрежение величиной перенапряжения полуреакций может привести к неправильному определению природы электродного процесса.
Возможные анодные реакции:
2 Cl- - 2 e → Cl2 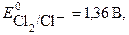
2H2O – 4 e 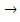 O2 + 4 H+
O2 + 4 H+ 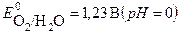
Потенциал окисления воды дан для кислого раствора (рН =0), с учетом подкисления раствора при электролизе.
Согласно величинам стандартных электродных потенциалов, на аноде должен выделятся кислород. В действительности на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода η0 = 1,17 В, что повышает потенциал окисления воды до 2,4 В.
Следовательно, электролиз раствора хлорида никеля протекает с образованием никеля и хлора: Ni2+ + 2Cl- = Ni + Cl2.
у катода у анода