Ответ: 25.
Ответ: 25
Источник: РЕШУ ЕГЭ
1. К реакциям обмена относят
1) гидролиз солей алюминия 2) дегидрирование спиртов
3) галогенирование алканов 4) реакцию щелочных металлов с водой
5) реакцию нейтрализации
Пояснение.
Реакция обмена - химическая реакция между двумя соединениями, при которой проходит обмен между обеими реагентами, реакционными группами или ионами.
Из приведенных примеров это реакция нейтрализации и гидролиз солей алюминия.
Ответ: 15.
Ответ: 15
Источник: РЕШУ ЕГЭ
2. Оксид цинка вступает в реакцию соединения с
1)  2)
2)  3)
3)  4)
4)  5)
5) 
Пояснение.
Оксид цинка — амфотерный оксид, вступает в реакции соединения с кислотными и основными оксидами.
Ответ: 14.
Ответ: 14|41
14|41
Источник: РЕШУ ЕГЭ
3. Алюминий вступает в реакцию замещения с
1)  2)
2)  3)
3)  4)
4)  5)
5) 
Пояснение.
Признаками реакции замещения в органической химии являются следующие: из 2 веществ образуется 2 вещества, углеродный скелет не разрушается, атом или группа атомов замещается на другой атом или группу атомов. Признаком реакции замещения в неорганической химии является взаимодействие простого и сложного вещества, как правило реакция окислительно-восстановительная. Алюминий вступает в реакцию замещения с оксидами менее активных металлов.
Ответ: 25.
Ответ: 25
Источник: РЕШУ ЕГЭ
4. К реакциям замещения относится взаимодействие брома с
1) водородом 2) этиленом 3) бутаном
4) бромидом железа (II) 5) толуолом
Пояснение.
Признаками реакции замещения в органической химии являются следующие: из 2 веществ образуется 2 вещества, углеродный скелет не разрушается, атом или группа атомов замещается на другой атом или группу атомов. Признаком реакции замещения в неорганической химии является взаимодействие простого и сложного вещества, как правило реакция окислительно-восстановительная.
Ответ: 35.
Ответ: 35
Источник: РЕШУ ЕГЭ
Пояснение.
Ароматические углеводороды склонны к реакциям электрофильного замещения.
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
4. Реакцией присоединения является взаимодействие формальдегида с
1)  2)
2)  3)
3)  4)
4)  5)
5) 
Пояснение.
Для формальдегида характерны реакции присоединения водорода, аммиака за счет разрыва двойной связи карбонильной группы альдегида.
Ответ: 14.
Ответ: 14
Источник: РЕШУ ЕГЭ
5. Реакцией замещения является взаимодействие хлорэтана с
1)  2)
2)  3)
3) 
4)  5)
5) 
Пояснение.
Признаками реакции замещения в органической химии являются следующие: из 2 веществ образуется 2 вещества, углеродный скелет не разрушается, атом или группа атомов замещается на другой атом или группу атомов. Признаком реакции замещения в неорганической химии является взаимодействие простого и сложного вещества, как правило реакция окислительно-восстановительная.
Ответ: 45.
Ответ: 45
Источник: РЕШУ ЕГЭ
6. Окислительно-восстановительной реакцией является взаимодействие в водном растворе сульфата меди(II) c
1)  2)
2)  3)
3)  4)
4)  5)
5) 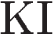
Пояснение.
В данном случае окислительно-восстановительной реакцией будет реакция замещения на цинк, а также реакция с йодидом калия.
Ответ: 25.
Ответ: 25
Источник: РЕШУ ЕГЭ
7. Окислительно-восстановительной реакцией является взаимодействие гидроксида меди(II) c
1) серной кислотой 2) аммиаком 3) уксусной кислотой
4) кислородом 5) этаналем
Пояснение.
Окисление гидроксидом меди (II) — одна из качественных реакций на альдегиды.
Окислительно-восстановительной является реакция гидроксида меди (II) с этаналем. Также гидроксид меди(II) может взаимодействовать с кислородом в воздухе образуя оксид меди (III).
Ответ: 45.
Ответ: 45
Источник: РЕШУ ЕГЭ
8. Cl2 вступает в реакцию замещения с
1)  2)
2)  3)
3)  4)
4)  5)
5) 
Пояснение.
Признаками реакции замещения в органической химии являются следующие: из 2 веществ образуется 2 вещества, углеродный скелет не разрушается, атом или группа атомов замещается на другой атом или группу атомов. Признаком реакции замещения в неорганической химии является взаимодействие простого и сложного вещества, как правило реакция окислительно-восстановительная.
Ответ: 14.
Ответ: 14
Источник: РЕШУ ЕГЭ
9. Al2O3 вступает в реакцию соединения с
1)  2)
2)  3)
3)  4)
4)  5)
5) 
Пояснение.
Оксид алюминия — амфотерный оксид, вступает в реакцию соединения с кислотными и основными оксидами.
Ответ: 35.
Ответ: 35|53
35|53
Источник: РЕШУ ЕГЭ
10. Реакцией присоединения является взаимодействие 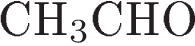 с
с
1)  2)
2)  3)
3)  4)
4)  5)
5) 
Пояснение.
Для ацетальдегида характерны реакции присоединения водорода, аммиака за счет разрыва двойной связи карбонильной группы альдегида.
Ответ: 14.
Ответ: 14
Источник: РЕШУ ЕГЭ
Пояснение.
Признаками реакции замещения в органической химии являются следующие: из 2 веществ образуется 2 вещества, углеродный скелет не разрушается, атом или группа атомов замещается на другой атом или группу атомов. Признаком реакции замещения в неорганической химии является взаимодействие простого и сложного вещества, как правило реакция окислительно-восстановительная.
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
11. Взаимодействие оксида меди(II) с углеродом является реакцией
1) окислительно-восстановительной 2) разложения
3) замещения 4) соединения 5) обмена
Пояснение.
Признаками реакции замещения в органической химии являются следующие: из 2 веществ образуется 2 вещества, углеродный скелет не разрушается, атом или группа атомов замещается на другой атом или группу атомов. Признаком реакции замещения в неорганической химии является взаимодействие простого и сложного вещества, как правило реакция окислительно-восстановительная.
Ответ: 13.
Ответ: 13
Источник: РЕШУ ЕГЭ
12. Взаимодействие оксида меди(II) с азотной кислотой является реакцией
1) соединения 2) кислотно-основной 3) разложения
4) замещения 5) обмена
Пояснение.
Взаимодействие оксида меди (II) и азотной кислоты будет являться реакцией обмена, а также кислотно-основной реакцией.
Ответ: 25.
Ответ: 25
Источник: РЕШУ ЕГЭ
13. Взаимодействие лития с водой – это реакция
1) каталитическая 2) экзотермическая 3) обратимая
4) эндотермическая 5) замещения
Пояснение.
 — реакция замещения, экзотермическая.
— реакция замещения, экзотермическая.
Ответ: 25.
Ответ: 25
Источник: РЕШУ ЕГЭ
14. Взаимодействие натрия и воды относится к реакциям
1) экзотермическая 2) каталитическая 3) необратимая
4) обратимая 5) эндотермическая
Пояснение.
Эта реакция идет с выделением теплоты и газа водорода (признак экзотермической необратимой реакции).
Ответ: 13.
Ответ: 13
Источник: РЕШУ ЕГЭ
15. Взаимодействие кислорода с оксидом серы (IV) относится к реакциям
1) эндотермическим 2) обмена 3) экзотермическим
4) соединения 5) замещения
Пояснение.
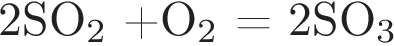 — это реакция соединения, практически все реакции соединения являются экзотермическими.
— это реакция соединения, практически все реакции соединения являются экзотермическими.
Ответ: 34.
Ответ: 34
Источник: РЕШУ ЕГЭ
16. Взаимодействие оксида кальция с водой относится к реакциям
1) экзотермическим 2) замещения 3) эндотермическим
4) обмена 5) соединения
Пояснение.
Это реакция соединения, практически все реакции соединения являются экзотермическими. Образуется щелочь — гидроксид кальция.
Ответ: 15.
Ответ: 15
Источник: РЕШУ ЕГЭ
17. Взаимодействие между глицерином и высшими карбоновыми кислотами
относится к реакциям
1) обмена 2) изомеризации 3) каталитическим
4) присоединения 5) этерификации
Пояснение.
Реакция между спиртом и кислотой носит название реакция этерификации, она приводит к образованию сложного эфира в присутствии катализатора.
Ответ: 35.
Ответ: 35
Источник: РЕШУ ЕГЭ
18. Взаимодействие хлорида меди (II) с железом относится к реакциям
1) разложения 2) обмена 3) замещения
4) окислительно-восстановительным 5) соединения
Пояснение.
Реакция замещения это реакция между простым и сложным веществом, в результате которой атомы простого вещества замещают атомы одного из элементов в сложном веществе при этом происходит изменение степеней окисления элементов.
Соль + металл = новая соль + новый металл.
Ответ: 34.
Ответ: 34
Источник: РЕШУ ЕГЭ
19. Взаимодействие карбоната калия с раствором хлорида магния относят к
реакциям
1) разложения 2) обмена 3) необратимым 4) замещения 5) соединения
Пояснение.
Взаимодействие карбоната калия с раствором хлорида магния относят к реакциям обмена.
Реакция обмена это реакция, протекающая между двумя сложными веществами, в результате которой они обмениваются своими составными частями. Обычно такие реакции необратимы.
Ответ: 23.
Ответ: 23
Источник: РЕШУ ЕГЭ
20. При нагревании дихромата аммония происходит реакция
1) обмена 2) замещения 3) разложения
4) соединения 5) экзотермическая
Пояснение.
Соли аммония термически нестабильны. При нагревании дихромата аммония происходит его экзотермическое разложение с образованием азота, оксида хрома (III) и воды.
Ответ: 35.
Ответ: 35
Источник: РЕШУ ЕГЭ
21. Взаимодействие водорода с кислородом относится к реакциям
1) соединения 2) разложения 3) экзотермическим
4) эндотермическим 5) разложения
Пояснение.
Это реакция соединения — из двух веществ получается одно.
Это экзотермическая реакция — при горении водорода в кислороде выделяется теплота.
Ответ: 13.
Ответ: 13
Источник: РЕШУ ЕГЭ
22. При нагревании карбоната аммония происходит реакция
1) необратимая 2) обмена 3) обратимая 4) замещения 5) разложения
Пояснение.
Если в реакции участвует одно сложное вещество, то возможна только реакция разложения. При этом эта реакция необратима.
Ответ: 15.
Ответ: 15
Источник: РЕШУ ЕГЭ
Пояснение.
При нагревании нитрата меди (II) протекает необратимая реакция разложения: 
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
23. Взаимодействие углерода с кислородом относится к реакциям
1) замещения 2) соединения 3) обмена
4) экзотермическим 5) эндотермическим
Пояснение.
Взаимодействие углерода с кислородом, конечно же, относят к экзотермическим реакциям соединения. При этом в зависимости от температуры и соотношения реагентов могут образовываться угарный или же углекислый газ.
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
24. Взаимодействие оксида серы (IV) с кислородом относится к реакциям
1) соединения 2) обмена 3) замещения
4) эндотермическим 5) экзотермическим
Пояснение.
Видно что данная реакция относится к реакциям соединения, кроме того, при этом происходит выделение теплоты — она экзотермическая.
Ответ: 15.
Ответ: 15
Источник: РЕШУ ЕГЭ
25. Взаимодействие карбоната кальция с раствором муравьиной кислоты относят к реакциям
1) разложения 2) обмена 3) обратимая 4) соединения 5) необратимая
Пояснение.
Видно что данная реакция относится к реакциям обмена, при этом она необратима.

Ответ: 25.
Ответ: 25
Источник: РЕШУ ЕГЭ
26. Взаимодействие оксида кальция и воды относится к реакциям
1) эндотермическим 2) каталитическим 3) обратимым
4) экзотермическим 5) необратимым
27. Взаимодействие оксида кальция с водой относится к реакциям
1) соединения 2) замещения 3) эндотермическим
4) экзотермическим 5) обмена
28. Взаимодействие меди с раствором нитрата серебра – это реакция
1) замещения 2) обмена 3) окислительно-восстановительная
4) соединения 5) разложения
Задание 21 № 8285 Задание 21. Скорость реакции. Д/з
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов при увеличении температуры и концентрации реагентов скорость реакции увеличивается. Для указанных агрегатных состояний реагентов изменения давления и формы сосуда с раствором щёлочи не влияет на скорость реакции.
Ответ: 35.
Ответ: 35
Источник: РЕШУ ЕГЭ
1. Какие два утверждения правильно характеризуют роль катализатора в химической реакции?
1) Катализатор вступает в реакцию с исходными веществами и расходуется в результате реакции.
2) Катализатор не смещает равновесие в сторону реагентов.
3) Катализатор увеличивает тепловой эффект реакции.
4) Катализатор ускоряет как прямую, так и обратную реакцию.
5) Катализатор смещает равновесие в сторону реагентов.
2Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов при увеличении температуры и концентрации реагентов скорость реакции увеличивается. Давление не будет влиять на скорость реакции между жидкими и твердыми веществами.
Ответ: 25.
Ответ: 25
Источник: РЕШУ ЕГЭ
. Скорость реакции азота с водородом уменьшится при
1) понижении температуры 2) понижении давления
3) увеличении концентрации азота 4) использовании катализатора
5) повышении давления в системе
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов при увеличении температуры и концентрации реагентов скорость реакции увеличивается. Для указанных агрегатных состояний реагентов понижение давления и температуры способствует уменьшению скорости реакции.
Ответ: 12.
Ответ: 12
Источник: РЕШУ ЕГЭ
3. Скорость реакции между метаном и кислородом увеличится при
1) сжатии смеси 2) охлаждении 3) нагревании
4) добавлении углекислого газа 5) добавлении азота
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов при увеличении температуры и концентрации реагентов скорость реакции увеличивается. Для указанных агрегатных состояний реагентов увеличение давления и температуры способствует увеличению скорости реакции.
Ответ: 13.
Ответ: 13
Источник: РЕШУ ЕГЭ
4. Скорость реакции между углеродом и кислородом увеличится при
1) увеличении объёма 2) охлаждении 3) нагревании
4) добавлении углекислого газа 5) измельчении углерод Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов при увеличении температуры и концентрации реагентов скорость реакции увеличивается. Для указанных агрегатных состояний реагентов увеличение площади поверхности твердых веществ и температуры способствует увеличению скорости реакции.
Ответ: 35.
Ответ: 35
Источник: РЕШУ ЕГЭ
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов при увеличении температуры и концентрации реагентов скорость реакции увеличивается. Для указанных агрегатных состояний реагентов уменьшение концентрации реагирующих веществ и охлаждение системы способствует уменьшению скорости реакции.
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
5. На скорость химической реакции
 (ж)
(ж)  (ж) →
(ж) →  (ж)
(ж)  (ж) не оказывает влияния:
(ж) не оказывает влияния:
1) повышение давления 2) повышение температуры
3) изменение концентрации 
3) изменение концентрации 
4) использование катализатора
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов при увеличении температуры и концентрации реагентов скорость реакции увеличивается. Для указанных агрегатных состояний реагентов уменьшение концентрации продуктов реакции и повышение давления не изменяет скорость реакции.
Ответ: 13.
Ответ: 13
Источник: РЕШУ ЕГЭ
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющие реакцию, но не входящие в состав продуктов реакции.
Для указанных агрегатных состояний реагентов увеличение температуры реакционной смеси и увеличение площади поверхности у твердого реагента способствует увеличению скорости реакции.
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющие реакцию, но не входящие в состав продуктов реакции.
Для указанных агрегатных состояний реагентов измельчение твердых реакционных веществ и нагревание реакционной смеси способствует увеличению скорости реакции.
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
6. На скорость протекающей в растворе химической реакции
 не влияет
не влияет
1) давление 2) концентрация  3) температура
3) температура
4) концетрация  5) концентрация
5) концентрация 
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющие реакцию, но не входящие в состав продуктов реакции.
Для указанных агрегатных состояний реагентов на скорости реакции не будет влиять концентрация продуктов и давление.
Ответ: 14.
Ответ: 14
Источник: РЕШУ ЕГЭ
7. Скорость реакции окисления оксида углерода(II) уменьшается при
1) понижении температуры 2) увеличении давления
3) использовании катализатора 4) понижении давления
5) увеличении концентрации кислорода
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов уменьшение температуры и концентрации реагентов (соляной кислоты) способствует уменьшению скорости реакции.
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов увеличение температуры и площади поверхности реагентов способствует увеличению скорости реакции.
Ответ: 15.
Ответ: 15
Источник: РЕШУ ЕГЭ
8. Увеличение концентрации азота увеличивает скорость реакций
1)  2)
2) 
3)  4)
4) 
5) 
Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Увеличение концентрации реагента (азота) способствует увеличению скорости реакций 2 и 4. В реакциях 1,3,5 азот является продуктом реакции.
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
9. Скорость реакции натрия с азотной кислотой не зависит от
1) концентрации кислоты 2) температуры
3) площади поверхности соприкосновения реагентов
4) концентрация водорода 5) давления
10Пояснение.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные), при увеличении давления (для газообразных реагентов). Так же скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющее реакцию, но не входящее в состав продуктов реакции.
Для указанных агрегатных состояний реагентов при увеличении температуры и измельчения твердых реакционных веществ скорость реакции увеличивается.
Ответ: 24.
Ответ: 24
Источник: РЕШУ ЕГЭ
. Какие два утверждения относительно катализаторов неверны?
1) Катализаторы входят в состав продуктов реакции
2) Катализаторы участвуют в химической реакции
3) Катализаторы участвуют в реакции и направляют её по другому пути,
но с теми же продуктами.
4) Катализаторы ускоряют как прямую, так и обратную реакцию
5) Катализаторы увеличивают тепловой эффект реакции.
Пояснение.
Катализатор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Он не расходуется в процессе реакции, не