Классификация химических реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
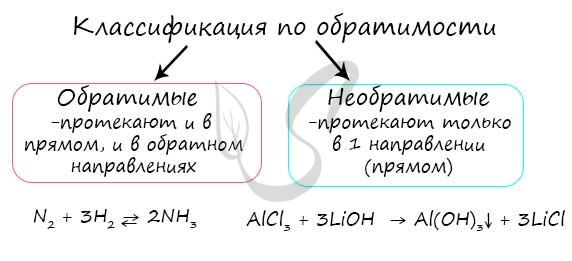
По характеру процесса
1. Соединения
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
4Na + O2= 2Na2O
P2O5+ 3H2O = 2H3PO4
2. Разложения
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
2KMnO4= K2MnO4+ MnO2+ 2O2
Сa(OH)2= CaO + H2O
3. Замещения
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
CuSO4+ Fe = FeSO4 + Cu
2KI + Cl2= 2KCl + I2
4. Обмена
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
2KOH + MgCl2= Mg(OH)2↓ + 2KCl
AgF + NaCl = AgCl↓ + NaF
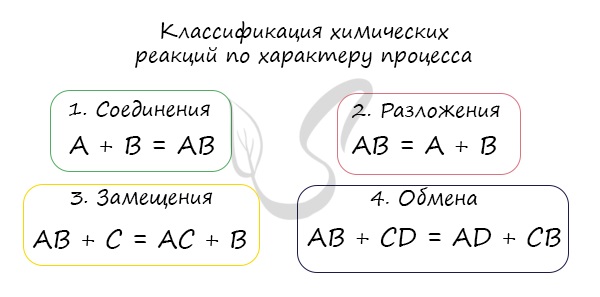
Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
I. Межмолекулярные - атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
K2SO3 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
II. Внутримолекулярные - атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
KMnO4→ K2MnO4+ MnO2+ O2
KClO3→ KCl + O2
III. Диспропорционирование - один и тот же атом является и окислителем, и восстановителем
KOH + Cl2 → (t) KCl + KClO3 + H2O
KOH + Cl2 → KCl + KClO + H2O
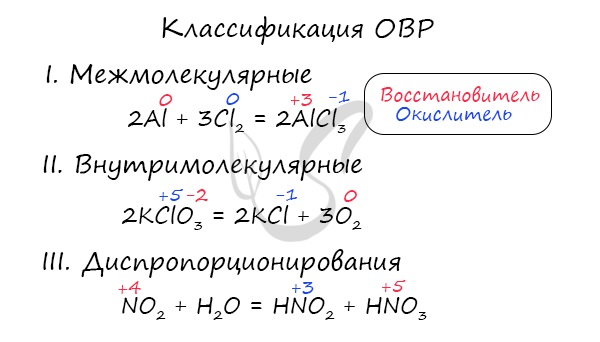
Окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: "Окислитель - понижает СО, восстановитель – повышает СО". Запомнив эту информацию таким образом, вы не будете путаться.
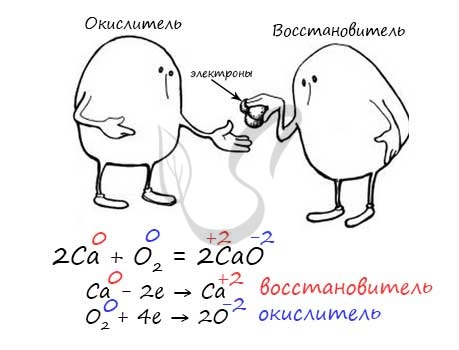
Обратимые и необратимые реакции
Обратимые реакции – такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака "=" ставят знак обратимости "⇆".
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
N2+ 3H2⇆ 2NH3
CH3COOH + C2H5OH ⇆ CH3COOC2H5 + H2O
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
o Образуются малодиссоциирующие вещества (например - вода, однако есть исключения - реакция этерификации)
o Реакция сопровождается выделение большого количества тепла
o В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
BaCl2+ H2SO4= BaSO4↓ + 2HCl (выпадает осадок)
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2(сопровождается выделением большого количества тепла)