1. 4HClг + O2г  2Cl2г + 2H2Oж.
2Cl2г + 2H2Oж.
2. Cl2г + 2HIг  I2к + 2HClг.
I2к + 2HClг.
3. SO2г + 2COг  2CO2г + Sк.
2CO2г + Sк.
4. СН4г + 2Н2Ог  СО2г + 4Н2г.
СО2г + 4Н2г.
5. СОг + 3Н2г  СН4г + Н2Ог.
СН4г + Н2Ог.
Вычислите стандартные изменения энергии Гиббса химической реакции при температуре 25 °С по значениям стандартных энтальпий образования и абсолютных энтропий химических соединений.
6. 4NH3г + 5O2г = 4NOг + 6H2Oг.
7. SO2г + 2H2Sг = 3Sк + 2H2Oж.
8. 2H2Sг + 3O2г = 2H2Oг + 2SO2г.
9. 2NOг + O3г + H2Oж = 2HNO3ж.
10. 3Fe2O3к + COг = 2Fe3O4к + CO2г.
11. 2СН3ОНж + 3О2г = 4Н2Ог + 2СО2г.
12. СН4г + 3СО2г = 4СОг + 2Н2Ог.
13. Fe2O3к + 3COг = 2Feк + 3CO2г.
14. С2Н4г + 3О2г = 2СО2г + 2Н2Ог.
15. 4NH3г + 3O2г = 6H2Oг + 2N2г.
Установите возможность самопроизвольного протекания реакции в стандартных условиях при температуре 25 °С по значениям стандартных энтальпий образования и абсолютных энтропий химических соединений.
16. 4NO2г + O2г + 2H2Oж = 4HNO3ж.
17. 2HNO3ж + NOг = 3NO2г + H2Oж.
18. 2С2Н2г + 5О2г = 4СО2г + 2Н2Ог.
19. Fe3O4к + 4H2г = 3Feк + 4H2Oг.
20. 2Fe2O3к + 3Cк = 4Feк + 3СО2г.
21. Fe3O4к + 4COг = 3Feк + 4CO2г.
22. 2H2Sг + O2г = 2H2Oж + 2Sк.
23. Fe2O3к + 3H2г = 2Feк + 3H2Oг.
Установите возможность самопроизвольного протекания реакций в стандартных условиях при температуре 350 °С по значениям стандартных энтальпий образования и абсолютных энтропий химических соединений. Температурной зависимостью DfH° и S° пренебречь.
24. 2РН3г + 4О2г = Р2О5к + 3Н2Ог.
25. Cl2г + SO2г + 2H2Oж = H2SO4ж + 2HClг.
26. Р2О5к + 5Ск = 2Рк + 5СОг.
27. 2COг + SO2г = Sк + 2CO2г.
28. СО2г + 4Н2г = СН4г + 2Н2Ог.
29. NOг + O3г = O2г + NO2г.
30. СН4г + 2О2г = СО2г + 2Н2Ог.
Химическая кинетика и химическое равновесие
Раздел I
1. В ходе газофазной реакции
2А + 3В ® С
за некоторый промежуток времени концентрация вещества А уменьшилась на 0,3 моль/л. Как и насколько изменилась при этом концентрация вещества В?
2. Чему равна скорость химической реакции, если концентрация одного из реагирующих веществ в начальный момент времени была равна 1,2 моль/л, а через 50 минут стала равной 0,3 моль/л?
3. Во сколько раз изменится скорость прямой реакции
2А + В  А2В,
А2В,
если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
4. Во сколько раз следует увеличить концентрацию вещества В2 в газофазной реакции
2А2 + В2 = 2А2В,
чтобы при уменьшении концентрации вещества А в 4 раза скорость реакции не изменилась?
5. При взаимодействии оксида серы (IV) и кислорода концентрация кислорода уменьшилась на 0,25 моль/л в течение часа. Как и насколько изменится при этом концентрация оксида серы (IV) и чему равна средняя скорость этой реакции по кислороду?
6. Прямая реакция между веществами А и В протекает по уравнению
2А + В = С.
Начальные молярные концентрации веществ А и В равны 4 и 3 моль/л соответственно. Константа скорости реакции равна 0,1 л2/(моль2×с). Найдите скорость реакции в тот момент, когда прореагирует 50 % вещества А.
7. Константа скорости прямой реакции
А + 2В = 3С
равна 0,6 л2/(моль2·с). Начальные молярные концентрации веществ А и В равны 2,0 и 2,5 моль/л соответственно. В результате реакции молярная концентрация вещества В оказалась равной 0,5 моль/л. Вычислите, какова молярная концентрация вещества А и скорость реакции.
8. Прямая газофазная реакция идет по уравнению
4NH3 + 5O2 = 4NO + 6H2O.
Как изменится скорость прямой реакции, если увеличить давление в 2 раза.
9. Как и во сколько раз изменится скорость образования аммиака из газообразных азота и водорода, если уменьшить вместимость реакционного сосуда в 5 раз?
10. Константа скорости прямой газофазной реакции
А + 2В = С
при некоторой температуре равна 0,4 л2/(моль2×с), а начальные молярные концентрации веществ А и В составили соответственно 0,3 и 0,5 моль/л. Вычислите скорость этой реакции после того, как прореагирует 0,1 моль/л вещества А.
11. При некоторой температуре константа скорости прямой газофазной реакции
H2 + I2 = 2HI
составляет 0,16 л/(моль×мин), а начальные молярные концентрации водорода и йода соответственно равны 0,04 и 0,05 моль/л. Вычислите скорость реакции в момент времени, когда С(Н2)=0,03 моль/л.
12. Во сколько раз надо увеличить концентрацию водорода, чтобы увеличить в 216 раз скорость реакции синтеза аммиака из водорода и азота?
13. Во сколько раз надо повысить давление при синтезе аммиака из газообразных водорода и азота, чтобы увеличить скорость этой реакции в 256 раз?
14. Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в обратимой газофазной реакции
2NO + O2  2NO2,
2NO2,
если увеличить давление в 5 раз?
15. Как изменится скорость прямой реакции
СаСО3(к) = СаО(к) + СО2(г),
если увеличить количество СаСО3 в 3 раза?
16. При температуре 100 °С скорость одной реакции вдвое превышает скорость другой реакции. При какой температуре скорости этих реакций станут равными, если температурный коэффициент скорости первой из них равен 2, а второй – 4?
17. Насколько нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7.
18. При повышении температуры с 20 до 60 °С скорость реакции возросла в 150 раз. Найдите температурный коэффициент реакции.
19. При температуре 353 К реакция длится 20 секунд. Температурный коэффициент скорости данной реакции равен 2,5. Сколько времени будет проходить реакция при температуре 293 К?
20. Определите температурный коэффициент скорости реакции, если при понижении температуры на 45 °С реакция замедлилась в 25 раз.
21. Константа скорости реакции при температуре 273 К равна 1,17 л/(моль×мин), а при температуре 298 К равна 6,56 л/(моль×мин). Найдите температурный коэффициент скорости реакции.
22. Температурный коэффициент скорости реакции разложения йодистого водорода равен 2. При температуре 629 К константа скорости равна 8,9×10-5 л/(моль×с). Вычислите константу скорости данной реакции при температуре 674 К.
23. При температуре 0 °С реакция заканчивается за 64 минуты. Сколько времени потребуется для завершения этой реакции при температуре 50 °С, если температурный коэффициент скорости реакции равен 2.
24. Две реакции при температуре 20 °С протекают с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, а второй реакции равен 3. Как будут соотноситься скорости реакций, если первую проводить при температуре 60 °С, а вторую при температуре 40 °С?
25. Вычислите, при какой температуре реакция закончится за 45 мин, если при температуре 293 К на это требуется 3 часа. Температурный коэффициент скорости реакции равен 3,2.
26. Во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С? Температурный коэффициент скорости реакции равен 3.
27. При температуре 150 °С реакция заканчивается за 16 мин. Рассчитайте, через какое время закончится эта реакция, если ее проводить при температуре 200 °С. Температурный коэффициент скорости реакции равен 2,5.
28. При температуре 393 К реакция заканчивается за 18 мин. Через какое время эта реакция закончится при температуре 453 К. Температурный коэффициент скорости реакции равен 3?
29. Константа скорости реакции первого порядка при температуре 288 К равна 2×10-2 с-1, а при температуре 325 К равна 0,38 с-1. Рассчитайте температурный коэффициент скорости этой реакции.
30. Две реакции протекают при температуре 283 К с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,5, а второй – 3,0. Как будут относиться скорости реакций, если первую из них провести при температуре 350 К, а вторую – при температуре 330 К?
Раздел II
1. В момент установления равновесия в системе
N2(г) + 3Н2(г)  2NH3(г)
2NH3(г)
молярные концентрации азота, водорода и аммиака соответственно равны 2,5; 1,8; и 3,6 моль/л. Вычислите константу химического равновесия и начальные молярные концентрации азота и водорода.
2. Химическое равновесие в гомогенной системе
А +2В  С
С
установилось при следующих молярных концентрациях веществ (моль/л): С(А) = 0,06; С(В) = 0,12; С(С) = 0,216. Вычислите константу равновесия и начальные молярные концентрации веществ А и В.
3. В реакционной массе, содержащей в начальный момент времени 3 моль/л кислорода и 5 моль/л водорода, в результате химической реакции образуется вода. В состоянии равновесия молярная концентрация продукта реакции составила 4 моль/л. Определите константу равновесия реакции.
4. Константа равновесия реакции
FeO(к) + СО(г)  Fe(к) + СО2(г)
Fe(к) + СО2(г)
при некоторой температуре равна 0,5. Найдите равновесные молярные концентрации СО и СО2, если их начальные молярные концентрации составляли соответственно 0,05 и 0,01 моль/л.
5. Реакция протекает согласно уравнению 2А  В. Начальная молярная концентрация вещества А равна 0,2 моль/л. Константа равновесия реакции Кс = 0,5. Определите равновесные молярные концентрации веществ А и В.
В. Начальная молярная концентрация вещества А равна 0,2 моль/л. Константа равновесия реакции Кс = 0,5. Определите равновесные молярные концентрации веществ А и В.
6. Через некоторое время после начала гомогенной реакции
4HCl + O2  2H2O + 2Cl2
2H2O + 2Cl2
при установившемся равновесии молярные концентрации веществ стали равными (моль/л) С(HCl) = 0,85; С(О2) = 0,44; С(Сl2) = С(Н2О) = 0,30. Определите начальные молярные концентрации НCl и О2.
7. Вычислите константу равновесия гомогенной реакции
N2 + 3H2  2NH3,
2NH3,
если начальные молярные концентрации азота и водорода составляли соответственно 6 и 13 моль/л, а в момент равновесия молярная концентрация аммиака была 8 моль/л.
8. В замкнутом сосуде протекает газофазная реакция
АВ  А + В.
А + В.
Определите начальную молярную концентрацию исходного вещества АВ, если известно, что константа равновесия реакции равна 0,04, а равновесная молярная концентрация вещества А составляет 0,02 моль/л.
9. Вычислите константу равновесия системы
H2 + I2  2HI,
2HI,
если реакция началась при молярных концентрациях водорода и иода, равных 1 и 0,6 моль/л соответственно, а в момент равновесия молярная концентрация HI была 1 моль/л.
10. Протекает газофазная реакция
3А + 2В  3С.
3С.
При установившемся химическом равновесии зафиксированы следующие молярные концентрации реагирующих веществ (моль/л): С(А) = 5; С(В) = 5; С(С) = 6. Определите молярные концентрации веществ А и В в начальный момент времени. Вычислите константу равновесия гомогенной реакции.
11. При температуре 713 К константа диссоциации HI равна 0,0156. Найдите концентрации H2, I2 и HI в состоянии равновесия, если вначале было взято 2 моль HI.Вместимость реакционного сосуда равна 5 л.
12. Константа равновесия гомогенной реакции
СО2 + Н2  СО + Н2О
СО + Н2О
равна 1. Рассчитайте равновесные молярные концентрации всех веществ, если начальные молярные концентрации водорода и диоксида углерода составляли соответственно 0,6 и 0,3 моль/л.
13. Начальные молярные концентрации оксида азота и хлора в газофазной реакции
2NO + Cl2  2NOCl
2NOCl
равны соответственно 0,5 и 0,2 моль/л. К моменту наступления равновесия прореагировало 20 % оксида азота. Вычислите константу равновесия реакции.
14. Константа равновесия гомогенной реакции
СО + Н2О  СО2 + Н2
СО2 + Н2
при некоторой температуре равна 1. Вычислите равновесные молярные концентрации всех веществ, если начальные молярные концентрации СО и Н2О были одинаковы и составляли 1 моль/л.
15. Начальные молярные концентрации оксида углерода (II) и паров воды равны и составили 0,03 моль/л. Вычислите равновесные молярные концентрации СО, Н2О и Н2 в гомогенной реакции
СО + Н2О  СО2 +Н2,
СО2 +Н2,
если известно, что равновесная молярная концентрация СО2 равна 0,01 моль/л.
16. Определите Кс газофазной реакции
2SO2 + O2  2SO3,
2SO3,
если начальные молярные концентрации веществ равны C(SO2) = 9 моль/л; С(О2) = 5 моль/л, а к моменту равновесия прореагировало 80 % кислорода.
17. Начальная молярная концентрация кислорода в гомогенной системе 3О2  2О3 была равна 1,2 моль/л. Вычислите Кс, если к моменту установления равновесия 70 % кислорода превратилось в озон.
2О3 была равна 1,2 моль/л. Вычислите Кс, если к моменту установления равновесия 70 % кислорода превратилось в озон.
18. Гомогенная реакция
Н2 + I2  2HI
2HI
началась при молярных концентрациях водорода и йода 1 и 0,6 моль/л соответственно. К моменту наступления равновесия прореагировало 50 % водорода. Определите Кс.
19. Реакция протекает по уравнению
А + В  2С.
2С.
Определите равновесные концентрации реагирующих веществ, если начальные молярные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции равна 50.
20. Вычислите равновесные молярные концентрации веществ в гомогенной реакции
CH4 + I2  CH3I + HI,
CH3I + HI,
если в исходной смеси было 2 моль/л метана и 3 моль/л йода, а константа равновесия была равна 1.
21. Начальные молярные концентрации исходных веществ SO2 и О2 в газофазной реакции
2SO2 + O2  2SO3
2SO3
были равны 1,6 и 1,2 моль/л соответственно. Найдите концентрации этих веществ в тот момент, когда образовалось 0,6 моль/л SO3.
22. 4 моль оксида серы (IV) и 2 моль кислорода смешаны при давлении 3,039·105 Па. К моменту наступления равновесия в смеси осталось 20 % SO2. Определите равновесные молярные концентрации SO2, O2 и образовавшегося оксида серы (VI) и давление, при котором установилось равновесие, если реакция велась в закрытом сосуде?
23. В газофазной реакции
CO + Cl2  COCl2
COCl2
исходные вещества взяты в эквивалентных количествах при давлении 1,013·105 Па. К моменту наступления равновесия в смеси осталось 50 % СО. Каким станет давление, если реакция велась в закрытом сосуде?
24. Как изменится давление в закрытом сосуде при протекании газофазной реакции
N2 + 3H2  2NH3,
2NH3,
если начальные молярные концентрации N2 и Н2 были равны 2 и 6 моль/л соответственно, а к моменту наступления равновесия доля прореагировавшего азота составила 10 %.
25. При данной температуре для гомогенной реакции
А +В  С +D
С +D
константа равновесия равна 1. В реакции участвовали 2 моль вещества А и 2 моль вещества В. Какая доля вещества А (в %) подверглась превращению?
26. Константа равновесия гомогенной реакции
А + В  С + D
С + D
равна 1. Начальные молярные концентрации веществ А и В составили 2 и 10 моль/л соответственно. Сколько процентов вещества А прореагировало?
27. Чему равны массовые доли Н2 и I2 в момент установления равновесия в реакции с образованием HI, если начальные молярные концентрации водорода и йода равны 1 моль/л, а константа равновесия при данной температуре равна 4?
28. Для газофазной реакции
2СО2  2СО + О2
2СО + О2
при данной температуре состав равновесной смеси в объемных долях равен 85,2 % СО2; 9,9 % СО и 4,9 % О2. Чему равна константа равновесия Кс этой реакции?
29. Исходные молярные концентрации СО, Н2О, СО2 и Н2 в газофазной реакции (моль/л)
СО + Н2О = СО2 + Н2
составляли 0,5, 0,6, 0,4 и 0,2 соответственно. Прореагировало 60 % Н2О. Вычислите молярные концентрации всех участвующих в реакции веществ.
30. Равновесные молярные концентрации веществ А, В, С и D в гомогенной реакции (моль/л)
А + В  С + D
С + D
составляли 18,0, 16,0, 24,0 и 12,0 соответственно. Концентрацию вещества С уменьшили на 12 моль/л, в результате чего равновесие было нарушено. Вычислите равновесные концентрации всех веществ после смещения равновесия.
Раздел III
1. Как повлияет на равновесие реакции
2SO2(г) + О2(г)  2SO3(г), DrH° = -179 кДж/моль
2SO3(г), DrH° = -179 кДж/моль
охлаждение реакционной смеси?
2. Сместится ли равновесие реакции
H2(г) + I2(г)  2HI(г)
2HI(г)
при повышении давления?
3. В какую сторону сместится равновесие реакции
N2(г) + 3H2(г)  2NH3(г), DrH° = -92 кДж/моль
2NH3(г), DrH° = -92 кДж/моль
при повышении температуры?
4. Как следует изменить температуру, чтобы равновесие в системе
СО2(г) + С(к)  2СО(г); DН > 0
2СО(г); DН > 0
сместилось влево?
5. В какую сторону сместится равновесие в системе
Na2CO3(к) + Н2О(ж) + СО2(г)  2NaHCO3(к)
2NaHCO3(к)
при увеличении давления?
6. Будет ли обратимой реакция
СаСО3(к) 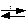 СаО(к) + СО2(г) ,
СаО(к) + СО2(г) ,
протекающая в открытом сосуде?
7. Как следует изменить давление в системе, чтобы равновесие
3Н2(г) + N2(г)  2NH3(г)
2NH3(г)
сместилось вправо?
8. В какую сторону сместится равновесие в системе
СН4(г) + Н2О(г)  СО(г) + 3Н2(г)
СО(г) + 3Н2(г)
при повышении давления?
9. Как повлияет повышение давления на равновесие обратимой реакции
H2SO4(ж) + 2NH3(г)  (NH4)2SO4(к).
(NH4)2SO4(к).
10. В системе установилось равновесие
3Fe2O3(к) + Н2(г)  2Fe3O4(к) + Н2О(г).
2Fe3O4(к) + Н2О(г).
Сместится ли оно при повышении давления?
11. В системе установилось равновесие
2NO(г) + Cl2(г)  2NOCl(г); DrН° = -73,6 кДж/моль.
2NOCl(г); DrН° = -73,6 кДж/моль.
В какую сторону оно сместится при понижении температуры?
12. В системе установилось равновесие
2О3(г)  3О2(г); DrН° = 290 кДж/моль.
3О2(г); DrН° = 290 кДж/моль.
В какую сторону оно сместится при повышении температуры?
13. В какую сторону в системе сместится равновесие
SO2(г) + 2CO(г)  2СO2(г) + S(к)
2СO2(г) + S(к)
при понижении давления?
14. В системе установилось равновесие
2HI(г)  Н2(г) + I2(г); DrН° = 52 кДж/моль.
Н2(г) + I2(г); DrН° = 52 кДж/моль.
В какую сторону оно сместится при повышении температуры?
15. В системе
СН4(г) + 2Н2S(г)  СS2(ж) + 4Н2(г)
СS2(ж) + 4Н2(г)
установилось равновесие. В какую сторону оно сместится при повышении давления?
16. В системе установилось равновесие
(NH4)3PO4(к)  3NH3(г) + H3PO4(ж).
3NH3(г) + H3PO4(ж).
В какую сторону оно сместится при повышении давления?
17. В какую сторону сместится равновесие системы
4NH3(г) + 5O2(г)  4NO(г) + 6H2O(г)
4NO(г) + 6H2O(г)
при повышении давления?
18. В системе установилось равновесие
2СО(г) + О2(г)  2СО2(г); DrH° =-135,2 кДж/моль.
2СО2(г); DrH° =-135,2 кДж/моль.
В какую сторону оно сместится при повышении температуры?
19. В какую сторону сместится равновесие реакции
Sп.бел. 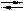 Sп.сер.; DrH° = -2,52 кДж/моль
Sп.сер.; DrH° = -2,52 кДж/моль
при понижении температуры?
20. В системе установилось равновесие
NH3(г) + H2O(ж)  NH4OH(ж).
NH4OH(ж).
Как изменится концентрация NH4OH(ж) при уменьшении давления?
21. В какую сторону в системе сместится равновесие
2NO(г) + O2(г)  2NO2(г)
2NO2(г)
при повышении давления?
22. В системе установилось равновесие
СаН2(к)  Са(к) + Н2(г).
Са(к) + Н2(г).
В какую сторону оно сместится при повышении давления?
23. В системе установилось равновесие
Cr2O3(к) + Al(к)  Al2O3(к) + 2Cr(к) DrH° = -120 кДж/моль.
Al2O3(к) + 2Cr(к) DrH° = -120 кДж/моль.
В какую сторону оно сместится при повышении температуры?
24. В системе установилось равновесие
NH4Cl(к)  NH3(г) + HCl(г).
NH3(г) + HCl(г).
В какую сторону оно сместится при повышении давления?
25. В системе установилось равновесие
2С2Н6(г)  С2Н4(г) + 3H2(г) + С2Н2(г).
С2Н4(г) + 3H2(г) + С2Н2(г).
В какую сторону оно сместится при понижении давления?
26. В какую сторону в системе сместится равновесие
SO3(г) + H2O(ж)  H2SO4(ж), DrH° =-88,2 кДж/моль
H2SO4(ж), DrH° =-88,2 кДж/моль
при повышении температуры?
27. В какую сторону в системе сместится равновесие
4HCl(г) + O2(г)  2Cl2(г) + 2H2O(г)
2Cl2(г) + 2H2O(г)
при повышении давления?
28. В системе установилось равновесие
СО2(г) + Н2О(ж)  Н2СО3(ж).
Н2СО3(ж).
В какую сторону оно сместится при понижении давления?
29. В системе установилось равновесие
Fe3O4(к) + 4H2(г)  3Fe(к) + 4H2O(г).
3Fe(к) + 4H2O(г).
В какую сторону оно сместится при повышении давления?
30. В какую сторону в системе сместится равновесие
SO2(г) + H2O(ж)  H2SO3(ж)
H2SO3(ж)
при понижении давления?