КОНТРОЛЯМ
Методическая разработка для студентов I курса
(Издание 2-е, исправленное и дополненное)
Иваново 2011
Составители: И.М. АРЕФЬЕВ,
Н.Г. ИВАНОВА,
А.В. ИОНОВ,
В.Б. ЛУКИНА,
М.И. ТРОФИМЕНКО
Редактор А.И. ПИРОГОВ
Данная работа содержит перечень типовых задач по следующим основным разделам курса химии, изучаемого студентами всех факультетов:
· основные законы химии;
· концентрация;
· строение вещества;
· химическая термодинамика;
· химическая кинетика и химическое равновесие;
· растворы неэлектролитов и электролитов;
· окислительно-восстановительные процессы;
· электрохимические процессы.
Каждый студент, имея в своем распоряжении данную разработку, в соответствии с программой курса химии и графиком учебного процесса может своевременно подготовиться к проведению текущего и промежуточного контролей, предлагаемых кафедрой по различным разделам курса, изучив предварительно соответствующий теоретический материал, изложенный в учебниках, учебных пособиях и конспекте лекций.
Систематическая работа над решением задач, содержащихся в данной методической разработке, способствует развитию химического мышления студента и позволяет использовать полученные теоретические знания для решения практических вопросов, что приводит к наиболее полному усвоению изучаемого материала.
Утверждена цикловой методической комиссией ТЭФ
Рецензент
кафедра химии и химических технологий в энергетике ГОУВПО «Ивановский государственный энергетический университет имени В.И. Ленина».
ОСНОВНЫЕ ЗАКОНЫХИМИИ
Раздел I
1. Какое количество вещества и сколько молекул при нормальных условиях содержится в 2,8 л газа?
2. Сколько молекул и какое количество вещества содержится в 15 г оксида азота (II)?
3. Молекула некоторого вещества имеет массу, равную 1,2.10-25 кг. Найдите относительную молекулярную массу вещества.
4. Масса 2 л газа (н.у.) равна 2,35 г. Вычислите относительную молекулярную массу газа и массу одной молекулы газа.
5. В какой массе диоксида серы (SO2) содержится столько же молекул, сколько их содержится в 2,5 л SO2 (н.у.)?
6. Вычислите массу 0,25 моль кислорода. Какой объем (н.у.) занимает это количество вещества? Сколько молекул кислорода содержится в этом объеме?
7. Определите, какое количество вещества и сколько молекул содержится в 552 г карбоната калия.
8. Какое количество вещества и сколько молекул содержится в 128 г оксида серы (IV)? Какой объем (н.у.) занимает это число молекул?
9. Рассчитайте молярную массу газа, если масса 1 мл его равна 1,96 мг (н.у.).
10. Рассчитайте массу 10 л азота при нормальных условиях.
11. Пары 0,0240 кг вещества при температуре 27 °С и давлении 912 мм рт.ст. занимают пространство объёмом 0,0250 м3. Какова молярная масса этого вещества?
12. В ёмкости вместимостью 1500 м3 при температуре –25 °С и давлении 4,00 атм содержится этилен. Определите его массу. Каким станет давление газа в ёмкости, если температура повысится до 25 °С?
13. 2,00.10–4 кг вещества, испарившись при температуре 22 °С и давлении 405 мм рт.ст., заняло объём 9,5.10-5 м3. Какова молярная масса этого вещества?
14. Какую массу будет иметь водород, занимающий при нормальных условиях объём 280 л?
15. Сколько литров оксида углерода (IV) выделится при действии хлороводородной кислоты на 25 г карбоната кальция при нормальных условиях?
16. Какой объем кислорода необходим для сгорания 3,36 л этилена (н.у.)?
17. Определите молярную массу газа, если 1,56 л газа при температуре 27 °С и давлении 1,037.105 Па имеют массу 2,86 г.
18. Относительная плотность газа по воздуху равна 0,9. Определите массу 1 л газа.
19. Из скольких атомов состоят молекулы: а) паров серы при температуре 950 °С, если относительная плотность их по воздуху равна 2,2; б) паров сурьмы при температуре 2000 °С, если относительная плотность их по водороду равна 60,88?
20. Какую массу карбоната кальция необходимо взять, чтобы полученным при его разложении оксидом углерода (IV) наполнить баллон вместимостью 40 л при температуре 15 °С и давлении 1,013.106 Па?
21. Вычислите относительную плотность по воздуху газа пропана (С3Н8), если его относительная плотность по водороду равна 22.
22. Какова масса 1 л газа, измеренного при нормальных условиях, если его молярная масса равна 71 г/моль?
23. Некоторый газ массой 5,6 г занимает объем 4,84 л при температуре 17 °С и давлении 0,997.105 Па. Чему равна относительная молекулярная масса этого газа?
24. Чему равна относительная молекулярная масса органического вещества, если оно массой 1,3 г в парообразном состоянии занимает объём 0,6 л при температуре 87 °С и давлении 8,3.104 Па?
25. Какой объём занимают 3,01.1023 молекулы углекислого газа при нормальных условиях?
26. Во сколько раз отличается число молекул, содержащихся в 20 г кислорода и 20 г водорода?
27. Какой объём занимает 11 г углекислого газа при температуре 27 °С и давлении 3 атм?
28. Какой объём занимают 50 г оксида серы (IV) при давлении 380 мм рт.ст. и температуре 47 °С?
29. Какое количество сульфида железа (FeS) необходимо взять, чтобы получить 100 л сероводорода при нормальных условиях?
30. Каково давление в сосуде вместимостью 22,4 л, содержащем 16 г оксида серы (IV) при температуре 0 °С?
Раздел II
Вычислите значения молярных масс эквивалентов указанных веществ в следующих реакциях:
1. HNO3 + Bi(OH)3 = Bi(OH)2NO3 + H2O.
2. H2S + NaOH = NaHS + H2O.
3. 3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O.
4. 2HCl + Bi(OH)3 = BiOHCl2 + 2H2O.
5. 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O.
6. H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O.
7. H2SO4 + KOH = KHSO4 + H2O.
8. H2SO4 + Mg = MgSO4 + H2.
9. Al(OH)3 + HCl = Al(OH)2Cl + H2O.
10. Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O.
11. 2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O.
12. H2CO3 + 2NaOH = Na2CO3 + H2O.
13. Fe(OH)2CH3COO + 3HNO3 = Fe(NO3)3 + CH3COOH + 2H2O.
14. Fe(OH)2NO3 + HNO3 = FeOH(NO3)2 + H2O.
15. CaCO3 + 2HCl = CaCl2 + H2O + CO2.
16. NaHCO3 + HCl = NaCl + H2O + CO2.
17. Cu(OH)2 + 2HCl = CuCl2 + 2H2O.
18. Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2.
19. KCr(SO4)2 + 3KOH = Cr(OH)3 + 2K2SO4.
20. KCr(SO4)2 + 2Ba(NO3)2 = 2BaSO4 + KNO3 + Cr(NO3)3.
21. Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4.
22. KAl(SO4)2 + 2BaCl2 = KCl + AlCl3 + 2BaSO4.
23. KAl(SO4)2 + 3KOH = Al(OH)3 + 2K2SO4.
24. H3AsO4 + 2NaOH = Na2HAsO4 + 2H2O.
25. CaHPO4 + H3PO4 = Ca(H2PO4)2.
26. CuOHCl + H2S = CuS + HCl + H2O.
27. H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O.
28. NaHSO4 + NaOH = Na2SO4 + H2O.
29. 3CaHPO4 + 3NaOH = Na3PO4 + Ca3(PO4)2 + 3H2O.
30. Fe(OH)2Cl + NaOH = Fe(OH)3 + NaCl.
Раздел III
1. Вычислите молярную массу эквивалентов, число эквивалентности и кислотность гидроксида алюминия, зная, что 1,95 г его прореагировало с 3,15 г азотной кислоты. Составьте уравнение реакции.
2. Определите молярную массу эквивалентов металла, зная, что для полного растворения 8,16 г этого металла потребовалось 20 г серной кислоты (ZH2SO4 = 2).
3. На нейтрализацию 0,944 г фосфористой кислоты (H3PO3) израсходовано 1,291 г гидроксида калия. Вычислите молярную массу эквивалентов, число эквивалентности и основность кислоты. Составьте уравнение реакции.
4. Определите массу оксида двухвалентного металла, которая пошла на реакцию с 5,6 л водорода (н.у.), если молярная масса эквивалентов оксида металла 39,77 г/моль.
5. Число эквивалентности серной кислоты в реакции с гидроксидом натрия равно 2. Какая масса гидроксида потребуется для реакции с 19,6 г кислоты.
6. 4,285 г металла вытесняют из кислоты 4 л водорода (н.у.). Вычислите молярную массу эквивалентов металла.
7. На нейтрализацию 3,655 г фосфорноватистой кислоты (H3PO2) израсходовано 2,222 г гидроксида натрия. Вычислите молярную массу эквивалентов и основность кислоты. Составьте уравнение реакции.
8. Какая масса алюминия растворилась в кислоте, если при температуре 18 °С и давлении 101 кПа выделилось 119 мл водорода?
9. Найдите молярную массу эквивалентов двух металлов по следующим экспериментальным данным: навеска первого металла массой 2,0000 г и навеска второго массой 1,0582 г образуют оксиды массой, соответственно равной 2,5036 и 2,0000 г.
10. При растворении в кислоте 11,9 г металла выделилось 2,24 л водорода (н.у.). Чему равна молярная масса эквивалентов металла?
11. Для растворения 16,86 г металла потребовалось 14,7 г серной кислоты. Вычислите молярную массу эквивалентов металла (ZH2SO4= 2).
12. На восстановление 1,8 г оксида металла израсходовано 883 мл водорода (н.у.). Найдите молярную массу эквивалентов этого металла.
13. Чему равна молярная масса эквивалентов металла, если его навеска массой 20 г вытесняет из кислоты водород объемом 7,5 л при температуре 18 °С и давлении 1,013.105 Па?
14. К раствору, содержащему 1 г соляной кислоты, прибавили раствор, содержащий 1 г гидроксида натрия. Будет ли полученный раствор нейтральным, кислым или щелочным? Ответ подтвердите расчетом.
15. Металл массой 0,50 г вытеснил из раствора кислоты 198 мл водорода, собранного и измеренного над водой при температуре 25 °С и давлении 745 мм рт.ст. Давление насыщенного водяного пара при этой температуре равно 23,8 мм рт.ст. Рассчитайте молярную массу эквивалентов металла.
16. При взаимодействии 6,75 г металла с серой образовалось 18,75 г сульфида. Рассчитайте молярную массу эквивалентов металла.
17. Металл массой 2,000 г вытесняет 1,132 г меди из раствора ее соли. Массовая доля кислорода в оксиде меди составляет 20 %. Определите молярную массу эквивалентов этого металла.
18. Массовые доли галогена в галогениде металла и кислорода в его оксиде соответственно равны 64,5 и 15,4 %. Определите молярную массу эквивалентов галогена и назовите его.
19. Бром массой 0,4586 г вытесняет из раствора иодида калия 0,7280 г йода, который взаимодействует с 0,5935 г металла. Определите молярную массу эквивалентов этого металла.
20. Определите молярную массу эквивалентов металла, если 0,046 г его вытеснили из кислоты 62,35 мл водорода, собранного над водой при температуре 17 °С и давлении 1,017.105 Па. Давление насыщенного пара над водой при температуре 17 °С равно 0,0193.105 Па.
21. Определите молярную массу эквивалентов металла, если 0,0350 г этого металла, содержащего 20 % не взаимодействующих с кислотой примесей, выделяют из кислоты 11,9 мл водорода, собранного над водой при температуре 17 °С и давлении 1,03.105 Па. Давление насыщенного водяного пара при температуре 17 °С равно 0,0193.105 Па.
22. Сколько оксида получится при окислении 3 г металла, молярная масса эквивалентов которого равна 9 г/моль?
23. Сколько оксида получится при окислении 3 г металла, молярная масса эквивалентов которого равна 12 г/моль?
24. При взаимодействии 1,28 г металла с водой выделилось 380 мл водорода, измеренного при температуре 21 °С и давлении 104,5 кПа. Давление насыщенного пара воды при этой температуре равно 2,49 кПа. Определите молярную массу эквивалентов металла.
25. 1,00 г некоторого металла соединяется с 8,89 г брома или с 1,78 г серы. Определите молярные массы эквивалентов брома и металла.
26. Определите молярные массы эквивалентов металла и серы, если 3,24 г металла образует 3,48 г оксида или 3,72 г сульфида.
27. Вычислите молярную массу эквивалентов металла, зная, что его хлорид содержит 79,78 % хлора. Молярная масса эквивалентов хлора равна 35,45 г/моль.
28. Мышьяк (As) образует два оксида, содержащих 65,2 и 75,7 % As. Рассчитайте молярную массу эквивалентов мышьяка в этих оксидах.
29. В 4,96 г оксида одновалентного металла содержится 3,68 г металла. Вычислите молярные массы эквивалентов металла и его оксида.
30. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалентов металла и его оксида.
КОНЦЕНТРАЦИЯ
Раздел I
1. Какой объем воды потребуется для растворения нитрата калия массой 8 г, если в приготовленном растворе массовая доля соли должна составить 0,01?
2. Если массовая доля соды в расчете на безводную соль равна 0,1, то какой она будет в расчете на кристаллогидрат (Na2CO3·10H2O)?
3. Какой объем воды потребуется для того, чтобы растворением 40 г кристаллогидрата (Na2SO4·10H2O) получить раствор, в котором массовая доля сульфата натрия была бы равна 0,08?
4. Смешаны два раствора, для которых ωKOH составляет соответственно 0,09 и 0,12. Масса первого раствора 120 г, второго 380 г. Определите массовую долю гидроксида калия в полученном растворе.
5. Чему равна масса безводного сульфата железа (II), массовая доля которого в водном растворе (r=1,10 г/мл) объемом 800 мл составляет 0,1?
6. Какую массу медного купороса (CuSO4·5H2O) надо добавить к водному раствору сульфата меди объемом 0,5 л и плотностью 1,040 г/мл для увеличения массовой доли соли с 0,04 до 0,16?
7. Какие массы растворов с массовой долей растворенного вещества 0,1 и 0,5 необходимо взять, чтобы получить раствор массой 800 г, для которого ωв=0,25?
8. До какого объема надо разбавить водный раствор хлорида натрия объемом 0,5 л (r=1,152 г/мл), для того чтобы уменьшить массовую долю соли с 0,20 до 0,04 (r=1,027 г/мл)?
9. Какая масса хлорида калия содержится в 400 мл 0,3М раствора?
10. В водном растворе объемом 250 мл содержится сульфат алюминия массой 7,5 г. Чему равна молярная концентрация сульфата алюминия в растворе?
11. В каком объеме 0,1М водного раствора содержится 4 г гидроксида натрия?
12. Раствор вещества А объемом 2 л смешан с раствором вещества В объемом 3 л. Концентрации веществ А и В до смешения были соответственно равны 6М и 1М. Определите молярную концентрацию каждого из этих веществ в полученном растворе.
13. Растворы одного и того же вещества с молярными концентрациями 1, 2 и 0,2 моль/л смешаны в объемных отношениях 1:2:7. Определите молярную концентрацию вещества в полученном растворе.
14. До какого объема надо разбавить водой раствор объемом 1,25 л, чтобы уменьшить его молярную концентрацию от 0,8 до 0,25 моль/л?
15. Смешаны два раствора с концентрацией 0,5н и 2,0н, взятые объемом соответственно 2 л и 0,5 л. Чему равна молярная концентрация эквивалентов вещества в полученном растворе?
16. Для исходного раствора концентрация равна 2,0н, а для полученного из него раствора объемом 500 мл та же величина равна 0,5н. Каков объем исходного раствора?
17. Какую массу карбоната натрия необходимо взять для приготовления 250 мл раствора с концентрацией 0,2н.
18. Для одного из исходных растворов концентрация равна 1,5н, а для другого 0,1н. Если последний раствор взять объемом 2 л, то какой объем первого раствора надо добавить к нему, чтобы концентрация вещества в полученном растворе составила 0,2н?
19. Для двух исходных растворов концентрация имеет значение 3,0н и 1,5н. Какой объем первого раствора следует добавить к 2,0 л второго, чтобы полученный раствор имел концентрацию 2,0н?
20. Сколько граммов воды необходимо добавить к 40 г гидроксида натрия, чтобы получить раствор с Сm(NaOH)=0,5 моль/кг.
21. Чему равна Сm(С6H12O6), если в 500 мл воды растворить глюкозу массой 9 г.
22. Какой массы надо взять сахарозу (С12H22O11) для приготовления водного раствора массой 200 г, чтобы Сm(С12H22O11)=0,05 моль/кг.
23. Найдите Сm(CuSO4) в растворе, полученном из безводной соли массой 50 г и воды объёмом 450 мл.
24. Какова молярная доля этилового спирта в растворе, содержащем 92 г спирта в 8 моль воды?
25. Какова молярная доля воды в растворе, содержащем 94 г фтористого бериллия (BeF2) в 144 мл воды?
26. Вычислите молярную долю серной кислоты в её водном растворе с ωH2SO4=0,3.
27. Вычислите молярные доли этилового спирта и воды в растворе с ωС2H5OH=0,96.
28. Определите титр серной кислоты, если плотность раствора равна 1,84 г/мл, а ωH2SO4=0,98.
29. Определите титр этилового спирта, если 6,9 г этилового спирта содержится в 100 мл раствора.
30. В каком объеме раствора будет содержаться 1 г хлорида натрия, если TNaCl=0,01 г/мл?
Раздел II
1. На нейтрализацию 500 мл раствора, содержащего 8 г гидроксида натрия, потребовалось 250 мл раствора кислоты. Вычислите молярную концентрацию эквивалентов кислоты.
2. На нейтрализацию некоторого количества гидроксида калия, находящегося в растворе, израсходовано 30 мл 0,1н раствора серной кислоты. Определите количество щелочи в растворе.
3. На нейтрализацию 1 л раствора, содержащего 1,56 г гидроксида калия, требуется 100 мл раствора кислоты. Вычислите молярную концентрацию эквивалентов кислоты.
4. Какой объём 0,2н раствора кислоты требуется для нейтрализации раствора, содержащего 0,40 г гидроксида натрия?
5. Какой объем 0,12н раствора гидроксида натрия потребуется для реакции с 40 мл 0,15н раствора серной кислоты?
6. Имеется 100 мл 0,1н раствора гидроксида натрия. Сколько миллилитров 0,1н раствора серной кислоты потребуется на его полную нейтрализацию?
7. Сколько миллилитров 0,25н раствора карбоната натрия нужно прибавить к 200 мл 0,4н раствора хлорида кальция, чтобы осадить кальций в виде карбоната кальция?
8. На нейтрализацию 40 мл раствора щелочи израсходовано 24 мл 0,5н раствора серной кислоты. Какова молярная концентрация эквивалентов щелочи.
9. Для нейтрализации раствора, содержащего 2,25 г кислоты, потребовалось 25 мл 2н раствора щелочи. Найдите значение молярной массы эквивалентов кислоты.
10. Какой объем 0,2н раствора гидроксида натрия потребуется для осаждения железа в виде гидроксида железа (III) из 0,5н раствора сульфата железа (III) объемом 100 мл.
11. На титрование 20 мл 0,12М раствора соляной кислоты расходуется раствор гидроксида натрия объемом 24 мл. Определите молярную концентрацию гидроксида натрия.
12. Какой объем 1М раствора соляной кислоты необходим для нейтрализации едкого калия, содержащегося в 10 мл 0,2М раствора гидроксида калия?
13. Определите молярную концентрацию эквивалентов серной кислоты, 15 мл которой взаимодействует без остатка с 30 мл 0,5н раствора хлористого бария.
14. Сколько граммов карбоната натрия можно разложить до угольной кислоты при действии на него 100 мл 4М раствора соляной кислоты?
15. Сколько литров 0,1М раствора нитрата серебра необходимо для обменной реакции с 0,5 л 0,3н раствора хлорида алюминия?
16. Сколько граммов карбоната кальция выпадет в осадок, если к 400 мл 0,5М раствора хлорида кальция прибавить эквивалентное количество раствора соды?
17. Для нейтрализации 20 мл 0,1н раствора кислоты потребовалось 8 мл раствора гидроксида натрия. Сколько граммов гидроксида натрия содержит 1 л этого раствора?
18. На нейтрализацию 20 мл раствора, содержащего в 1 л 12 г щелочи, израсходовано 24 мл 0,25н раствора кислоты. Рассчитайте молярную массу эквивалентов щелочи.
19. Для осаждения сульфата бария из 100 г раствора хлорида бария с ωBaCl2=0,15 потребовалось 14,4 мл серной кислоты. Определите Сэк(H2SO4).
20. Какой объем 0,5М раствора гидроксида натрия необходим для полной нейтрализации 200 г раствора фосфорной кислоты с ωH3РO4= 0,03?
21. На нейтрализацию 10 мл раствора, содержащего в 1 л 11,2 г щелочи, было израсходовано 20 мл 0,1н раствора кислоты. Вычислите молярную массу эквивалентов щелочи.
22. На нейтрализацию 1,28 г кислоты израсходовано 10 мл 1н раствора щелочи. Вычислите молярную массу эквивалентов кислоты.
23. На нейтрализацию 0,943 г фосфористой кислоты (H3PO3) израсходовано 10 мл 2,3н раствора щелочи. Определите основность кислоты.
24. Какой объем 5н раствора кислоты требуется для взаимодействия с 3,2 г гидроксида натрия?
25. Сколько миллилитров раствора серной кислоты с ωH2SO4=0,1 и плотностью 1,1 г/мл требуется для нейтрализации раствора, содержащего 16 г гидроксида натрия?
26. Какой объем 2н раствора кислоты требуется для взаимодействия с nэк(щелочи), равного 0,04 моль?
27. На нейтрализацию 4 мл 0,5н раствора щелочи потребовалось 20 мл серной кислоты. Определите, сколько граммов серной кислоты содержится в 1 л раствора?
28. Сколько граммов гидроксида калия требуется для взаимодействия с 250 мл 0,6н раствора кислоты?
29. Сколько граммов карбоната натрия требуется для взаимодействия с 250 мл 0,6н раствора кислоты с образованием угольной кислоты?
30. На нейтрализацию 31 мл 0,16н раствора щелочи потребовалось 217 мл раствора серной кислоты. Вычислите молярную концентрацию эквивалентов серной кислоты.
Раздел III
1. Сколько миллилитров раствора соляной кислоты с ωHCl=0,36 (r=1,19 г/мл) необходимо взять для приготовления 4 л раствора Сэк(HCl)=0,5 моль/л?
2. Вычислите молярную концентрацию фосфорной кислоты с ωH3PO4=0,49 (r=1,33 г/мл).
3. Рассчитайте массовую долю серной кислоты в 2М растворе, плотность которого 1,12 г/мл.
4. Сколько миллилитров 2М раствора хлорида натрия необходимо для приготовления 500 мл раствора с плотностью 1,02 г/мл, в котором ωNaCl=0,02?
5. Определите массовую долю карбоната калия в 2М растворе, плотность которого равна 1,21 г/мл.
6. Рассчитайте молярную долю гидроксида калия в водном растворе с ωKOH=0,15.
7. Какой объем 96%-ной серной кислоты (r=1,84 г/мл) надо взять для приготовления 1 л 2н раствора?
8. Определите CNaOH в растворе гидроксида натрия с ωNaOH=0,2 и плотностью раствора, равной 1,22 г/мл.
9. К воде массой 200 г прилили 2М раствор хлорида калия объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию хлорида калия в полученном растворе, если его плотность равна 1,015 г/мл.
10. К 3,5М раствору хлорида аммония объемом 80 мл и плотностью 1,05 г/мл прилили воду объемом 40 мл. Определите массовую долю соли в полученном растворе.
11. Определите массовую долю этилового спирта в 11М водном растворе с плотностью 0,9 г/мл.
12. Вычислите молярную концентрацию эквивалентов фосфорной кислоты в растворе с ωH3PO4=0,40 и r=1,25 г/мл.
13. Как из 2М раствора соды приготовить 0,25н раствор соды?
14. Какой объем воды нужно прибавить к 500 мл азотной кислоты с ωHNO3=0,4 и плотностью 1,25 г/мл для получения раствора с ωHNO3=0,1? Какова молярная концентрация азотной кислоты в полученном растворе?
15. Определите молярную концентрацию фосфорной кислоты в растворе с ωH3PO4= 0,2 и плотностью 1,1 г/мл.
16. Какой объем раствора серной кислоты с ωH2SO4= 0,44 и плотностью 1,60 г/мл требуется для приготовления 1 л 0,02н раствора?
17. Определите массовую долю сульфата хрома (Cr2(SO4)3) в 4н растворе с плотностью 1,21 г/мл.
18. Какой объем 0,4н раствора серной кислоты можно приготовить из 224 мл раствора серной кислоты с ωH2SO4= 0,5 и плотностью 1,4 г/мл?
19. Рассчитайте ТH2SO4 и Сэк(H2SO4), если ωH2SO4=0,2, а плотность равна 1,15 г/мл.
20. Какой объем раствора с ωH2SO4=0,1 и r=1,07 г/мл необходимо взять для приготовления 1 л раствора с титром 0,001 г/мл?
21. 1 мл раствора с ωВ=0,25 содержит 0,458 г растворенного вещества. Какова плотность этого раствора?
22. Какое количество вещества гидроксида калия находится в 5 л раствора, если плотность раствора гидроксида калия с ωKOH= 0,26 равна 1,24 г/мл?
23. Рассчитайте моляльность азотной кислоты в растворе с ωHNO3= 0,4.
24. Вычислите моляльность серной кислоты в растворе с ωH2SO4= 0,15.
25. Титр раствора хлорида кальция равен 0,0222 г/мл. Рассчитайте молярную концентрацию хлорида кальция.
26. Плотность 0,01М водного раствора сульфата железа (III) равна 1 г/мл. Определите Сэк(Fe2(SO4)3) и ωFe2(SO4)3.
27. Рассчитайте моляльность хлорида бария в растворе с ωBaCl2= 0,25.
28. Вычислите молярную долю серной кислоты в растворе с ωH2SO4=0,25.
29. Вычислите молярную долю щелочи в растворе с ωNaOH= 0,1.
30. Сколько литров аммиака, измеренного при нормальных условиях, необходимо растворить в 200 мл воды для получения раствора с ωNH3=0,1?
СТРОЕНИЕ ВЕЩЕСТВА
Раздел I
1. Какой физический смысл имеет волновая функция y и квадрат модуля волновой функции |y|2?
2. Объясните физический смысл понятия «атомная орбиталь» (АО).
3. Зависит ли максимальное число электронов, образующих данную атомную орбиталь, от комбинации квантовых чисел n, l, ml?
4. Каковы значения квантовых чисел n, l, ml, для 3d атомных орбиталей?
5. Какими значениями орбитального квантового числа характеризуется состояние электрона с минимальной и максимальной энергией на энергетическом уровне n = 3?
6. Чему равно число энергетических подуровней для данного энергетического уровня? Каким значением главного квантового числа характеризуется энергетический уровень, если он расщеплен на 4 подуровня?
7. Какие квантовые числа определяют размер, форму и ориентацию в пространстве электронного облака?
8. Что показывает величина 2n2?
9. Какими параметрами отличаются 2р- и 3р- атомные орбитали?
10. Какие из перечисленных обозначений АО не имеют физического смысла: 4f, 2d, 2s, 5p, 1p, 3f, 7p?
11. Запишите электронные формулы атомов элементов с зарядом ядра 15, 25, 60, 82.
12. Укажите значения квантовых чисел n и l для внешних электронов в атомах элементов с порядковым номером 11, 33, 55.
13. Запишите электронные формулы ионов Ca2+, Al3+, S2-.
14. Назовите элемент, у атома которого в основном состоянии конфигурация АО последнего и предпоследнего уровней изображается комбинацией символов 4s23d104  4
4  4
4  .
.
15. Воспользовавшись правилом Клечковского, предскажите электронный уровень, на который поступит электрон, добавляемый к электронной структуре атомов Zn, Sr, Ra?
16. Какая группа элементов имеет следующую электронную конфигурацию внешних уровней: (n - 1)d5ns2?
17. Какие ионы имеют электронную конфигурацию, одинаковую с атомом аргона?
18. Одинаковое ли количество энергии поглощает атом при следующих переходах электронов: 3р ® 3d и 3p ® 4s? Если не одинаковое, то при каком переходе больше?
19. Энергия ионизации в процессе Mg1+ ® Mg2+ + 
 вдвое превышает энергию ионизации в процессе Mg ® Mg1+ +
вдвое превышает энергию ионизации в процессе Mg ® Mg1+ +  . Удаление третьего электрона требует в десять раз больше затраты энергии, чем при удалении первого. В чем причина такого резкого отличия?
. Удаление третьего электрона требует в десять раз больше затраты энергии, чем при удалении первого. В чем причина такого резкого отличия?
20. Энергия ионизации в процессе 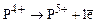 равна 6270 кДж/моль. Энергия ионизации в процессе
равна 6270 кДж/моль. Энергия ионизации в процессе  равна 16100 кДж/моль. В чем причина столь большого различия?
равна 16100 кДж/моль. В чем причина столь большого различия?
21. Как отличаются друг от друга энергии ионизации атомов: а) Na и Cl, б) K и Kr, в) Ве и Ва? Ответ обоснуйте.
22. Ион Li2+ и атом водорода имеют по одному 1s1-электрону. Различны или одинаковы энергии ионизации этих частиц?
23. Назовите элементы, атомы которых обладают самым большим сродством к электрону, самой низкой энергией ионизации.
24. Какой вывод можно сделать о свойствах элемента по значению его энергии ионизации и сродства к электрону?
25. Ионы Li+ и Н- имеют одинаковое число электронов. Радиус какого иона больше?
26. Зависит ли максимальное число электронов, находящихся на данной атомной орбитали, от комбинации квантовых чисел?
27. Сколько вакантных 3d-орбиталей имеют возбужденные атомы Cl и Mn?
28. Чему равно число неспаренных р-электронов у атома серы в невозбужденном состоянии.
29. Как принцип Паули объясняет химическую инертность элемента с порядковым номером «два»?
30. Скорость движения электрона равна 109 м/с. Рассчитайте длину волны электрона, если постоянная Планка h = 6,626·10-34 Дж·с, а масса электрона равна 9,11·10-31 кг.
Раздел II
1. Объясните термин «перекрывание атомных орбиталей».
2. Может ли ковалентность атома в соединениях быть равной нулю или принимать не только положительные, но и отрицательные значения?
3. Приведите схему перекрывания атомных орбиталей в молекулах Cl2, HCl, O2, N2.
4. Можно ли сказать, что благородные газы He, Ne и другие состоят из молекул?
5. Чему равна минимальная и максимальная ковалентность атома азота?
6. Почему хлорводородная кислота сильнее фторводородной?
7. Что является причиной образования любой химической связи? Каким энергетическим эффектом сопровождается этот процесс?
8. Как изменяется прочность связи в ряду HF, HCl, HBr, HI? Укажите причины этих изменений.
9. Предскажите, какая из связей прочнее: а) С – F или C – Br; б) С = О или С – О; в) О – О или S – S.
10. Расположите следующие связи в порядке увеличения полярности: Na – O, Na – F, Na – N.
11. Расположите указанные ниже связи в порядке возрастания полярности: а) H – F, H – C, H – H; б) P – S, Si – Cl, Al – Cl.
12. Как называется расстояние между атомами в ковалентной молекуле, и каким образом оно влияет на прочность химических связей?
13. Почему и как влияет размер атомов на длину и энергию образующейся между ними связи?
14. Чем объясняется большая устойчивость системы из двух связанных атомов (например, Н2) по сравнению с системой из двух свободных атомов (2Н)?
15. Чем объясняется способность атомов многих элементов к образованию числа связей, превышающих число неспаренных электронов в их атомах?
16. Укажите причины, способствующие гибридизации атомных орбиталей.
17. Объясните, каким образом атом углерода, имеющий два неспаренных электрона, может проявлять ковалентность, равную четырем?
18. Сравните механизм образования ковалентных связей в молекулах СН4, NH3 и в ионе 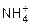 .
.
19. Приведите схему перекрывания атомных орбиталей в молекулах BeCl2 и BF3.
20. Какая из молекул HCl, HBr, HI имеет наибольшую длину диполя?
21. Какая из связей Са – Н, С – S, I – Cl является наиболее полярной? К какому из атомов смещено электронное облако?
22. Расположите в порядке возрастания степени ионности связи В – Cl, Na – Cl, Ca – Cl, Be – Cl.
23. Для каких связей длина диполя равна а) нулю; б) меньше длины связей; в) равна длине связей?
24. Укажите донор и акцептор в реакции Н2О + Н+ = Н3О+.
25. Какая из следующих молекул должна иметь наибольший дипольный момент: NH3, PH3, AsH3, BH3?
26. Сколько электронов участвует в образовании молекулы этилена (С2Н4) от атомов углерода и водорода?
27. Какая связь называется водородной? Как она влияет на свойства веществ?
28. Какие три вида межмолекулярного взаимодействия называют ван-дер-ваальсовыми силами?
29. Что называют кратностью связи? Чему она равна, если от двух взаимодействующих атомов в ее образовании участвовало: 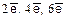 .
.
30. Какое межмолекулярное взаимодействие является универсальным и действует между любыми частицами?
Раздел III
1. Чем обусловлена периодичность изменения свойств элементов?
2. Элементы с какими свойствами начинают и с какими свойствами заканчивают любой период?
3. Какими свойствами обладают элементы, называемые переходными?
4. В чем заключается принципиальное различие между элементами главных и побочных подгрупп?
5. Какова основная тенденция изменения радиусов элементов главных подгрупп в пределах периода с увеличением заряда ядра атомов?
6. Как изменяются энергия ионизации, энергия сродства к электрону, электроотрицательность элементов главных подгрупп в пределах периода с увеличением заряда ядра атомов?
7. Как изменяются энергии ионизации и сродства к электрону, электроотрицательность элементов в пределах подгруппы?
8. Какие элементы имеют наибольшие и наименьшие значения энергий ионизации и сродства к электрону, электроотрицательности?
9. Как изменяется характер элементов главных подгрупп в пределах периода и в пределах подгрупп с увеличением заряда ядер атомов?
10. Какие из s-элементов в виде простых веществ являются: а) газообразными неметаллами; б) металлами?
11. Назовите причины, по которым в периоде с возрастанием заряда ядра атомов неметаллические свойства элементов главных подгрупп увеличиваются.
12. Назовите причины, по которым у элементов главных подгрупп в пределах группы с ростом заряда ядра атомов металлические свойства увеличиваются.
13. Какой из элементов Li, Na, K, Rb, Cs проявляет наиболее ярко выраженные металлические свойства?
14. К какому классу веществ относятся элементы, имеющие один или два электрона во внешнем электронном слое?
15. К какому классу веществ относятся элементы, у которых полностью застроен внешний энергетический уровень?
16. К какому классу веществ относятся переходные элементы? Как изменяются свойства переходных элементов в пределах периода? Ответ мотивируйте.
17. К какому классу веществ относятся лантаноиды и актиноиды? Как и