по химии
Студента(ки).......................................................................факультета
Ф.И.О………………………………………………………………..
(шифр ……………………..)
Преподаватель
………………………………………………………………
Журнал начат ………………………………… 20.....г.
Журнал закончен. 20.....г.
Элементы теории, примеры зачетных задач
В общем виде для гомогенной реакции: mA+nB=pD+qE закон действия масс (ЗДМ) выражается как: v=k C(A)m C (B)n, где С(А), С(B) - молярные концентрации веществ А и В; m, n - стехиометрические коэффициенты; k - константа скорости реакции..
В гетерогенных процессах концентрация кристаллического вещества постоянна, поэтому она учитывается в константе скорости и не входит в выражение ЗДМ.
Пример 1. Как и во сколько раз изменится скорость гомогенной газовой реакций 2NO+Н2=N20+Н20 при увеличении концентрации NO в системе в три раза?
Решение
До увеличения концентрации: v1=kC(NO)2C(H2)
После увеличения концентрации:
v2=k{3C(NO)}2C(H2)=9kC(NO)2C(H2)=9v1
Скорость реакции увеличилась в 9 раз.
Пример 2. Как и во сколько раз изменятся скорости реакций при уменьшении давления в системах в три раза:
а) Для гомогенного газового процесса: 2NO+Cl2=2NOCl?
б) Для гетерогенного процесса: СаО(к) + SO3(г) = СаSO4(к)?
Решение
а) До уменьшения давления: v1=kC(NO)2C(Cl2).
Уменьшение давления при постоянной температуре приведет к пропорциональному увеличению объема системы и уменьшению концентраций газообразных веществ:
v2=k{1/3C(NO)}2•1/3C(Cl2)=1/27kC(NO)2C(Cl2)=1/27 v1. Скорость реакции уменьшилась в 27 раз.
б) v1=kC(SO3).
v2=k•1/3 C(SO3)=1/3 v1
Скорость реакции уменьшилась в 3 раза.
--------------------------------------------------------------------------------------------------------------
Катализаторы - это вещества, которые, как правило, селективно увеличивают скорость химических реакций, принимают участие в промежуточных процессах, регенерируются в ходе реакций и не входят в состав конечных продуктов.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 1
Общие закономерности химических реакций
опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ (закон действия масс)
Уравнение реакции взаимодействия тиосульфата натрия и серной кислоты: Na2S2O3+ Н2SO4=S↓+Н2O+SO2+Na2SO4. Скорость реакции выразим через изменение концентрации выпадающей в осадок серы ∆С(S): v=∆С(S)/t. Опалесценсия раствора становится заметной при определенном ∆С(S). Поэтому v∞1/t, а величину v'=1/t можно принять за относительную скорость.
Выражение ЗДМ для данной реакции:................................
Таблица измерений и расчетов:
| № измер. | Объем, см3 | Относ, конц. Na2S2O3 | Время появлен. опалесц., t, c | Условн. скорость v’=1/t, с -1 | Относит, скорость v=v’/vmin | |||
| Na2S2O3 | Н2O | Н2SO4 | Общий | |||||
| - | ||||||||

 График теоретической и экспериментальной зависимости относительной скорости реакции у от относительной концентрации тиосульфата натрия С (Na2S2O3):
График теоретической и экспериментальной зависимости относительной скорости реакции у от относительной концентрации тиосульфата натрия С (Na2S2O3):
Вывод (о выполнении закона действия масс для данной конкретной реакции):
_________________________________________________
_________________________________________________
_________________________________________________
_________________________________________________
_________________________________________________
_____________________________________________________________________
опыт 2. Зависимость скорости от катализатора
а) Реакция разложения пероксида водорода без катализатора:
…………………………………………………………………………………………
б) Гомогенный катализ
{}
Элементы теории, примеры зачетных задач
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газ или раствор).
При гетерогенном катализе катализатор находится в системе в виде самостоятельной фазы (обычно твердое вещество). Все реакции протекают на его поверхности.
--------------------------------------------------------------------------------------------------------
Реакции, которые с заметной скоростью протекают и в прямом, и обратном направлениях, называются обратимыми. Они идут не до конца, ни одно из реагирующих веществ не расходуется полностью.
Состояние, при котором скорость прямой реакции равна скорости обратной реакции называется химическим равновесием. Оно может продолжаться сколь угодно долго, если не изменять внешних условий. Концентрации участников реакции в состоянии равновесия называются равновесными. Их обозначают квадратными скобками. Равновесие характеризуется константой химического равновесия К Для обратимой гомогенной реакции mА+nВ <=> рD+qЕ:
K= 
Величина константы равновесия от концентрации не зависит. В выражение константы равновесия гетерогенных реакций не входят концентрации кристаллических веществ.
Изменение параметров системы, приводящее ее к новому состоянию равновесия путем преимущественного протекания прямого или обратного процессов, называется смещением химического равновесия соответственно в прямом или обратном направлении.
Качественные задачи смещения химического равновесия могут быть решены с помощью принципа Ле Шателье: если на систему, находящуюся в состоянии равновесия, оказать какое-либо внешнее воздействие, то в результате протекания процессов в системе равновесие сместится в направлении, приводящем к уменьшению оказанного воздействия.
Пример 3. Напишите выражение для константы равновесия гетерогенного процесса: А2(Г)+2В(К)<=> 2АВ(Г); ∆Н>0. Как увеличение давления отразится на состоянии равновесия? В каком направлении сместится равновесие при уменьшении температуры?
в) Гетерогенный катализ (уравнение реакции (а) с указанием катализатора и фазовой принадлежности участников реакции):
__________________________________________________________________________________________________________________________________________________________________________________________________________________
опыт 3. Смещение химического равновесия при изменении концентрации реагирующих веществ
Уравнение обратимой реакции: FеС13+ЗКSСN<=> Fe(SCN)3+ЗКСl Интенсивную красную окраску имеет один из продуктов реакции, роданид железа Fе(SCN)з.
| Добавлено в раствор | Изменение интенсивности окраски (усиление или ослабление) | Направление смещения равновесия (вправо или влево) | Выражение для константы равновесия данной реакции: K = |
| FеСl3 | |||
| КSСN | |||
| КСl |
Как зависит к от концентраций FеСl3, КSСN, КС1?
__________________________________________________________________________________________________________________________________________________________________________________________________________________
Вывод (конкретно о выполнении принципа Ле Шателье для данного опыта):
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата: Подпись преподавателя
Элементы теории, примеры зачетных задач
Решение
К=[АВ]2/[А2].
По принципу Ле Шателье при увеличении давления равновесие сместится в сторону процесса, приводящего к уменьшению давления, т.е. в сторону меньшего количества моль газов. Поскольку из 1 моль газа образуется 2 моль газа, при увеличении давления равновесие сместится в обратном направлении, влево.
При уменьшении температуры равновесие сместится в сторону реакции, сопровождающейся увеличением температуры, т.е. в сторону экзотермической реакции. Если прямая реакция эндотермическая (∆Н>0), то обратная - экзотермическая. Следовательно, при уменьшении температуры равновесие сместится в сторону обратной реакции, влево.
________________________________________________________________________
Индикаторами называются слабые органические кислоты (HInd) или основания (Ind’OH), которые изменяют окраску в зависимости от рН раствора, поскольку их молекулярная и ионная форма в растворе имеют различную окраску.
________________________________________________________________________
Гидролизом называется взаимодействие ионов соли с молекулами воды, приводящее за счет образования слабого электролита к смещению ионного равновесия воды.
Пример 4. Гидролиз сульфата и хлорида хрома, Сr2(SO4)3 и СrС1з. Соли образованы слабым основанием Сr(ОН)3 и сильными кислотами Н2SО4 и НСl, соответственно. Гидролизу подвержен ион, образующий слабый электролит. Поэтому гидролиз обеих солей протекает по катиону:
Сr3++НОН <=>С rОН2++Н+. Среда кислая, рН<7.
Молекулярные уравнения:
Сr2(SO4)3+2Н2O <=> 2Сr(OН)SO4+Н2SO4.
СrСl3+Н2O <=>Сr(ОН)Сl2+НСl.
Пример 5. Гидролиз фосфата калия К3РО4. Соль образована слабой кислотой Н3РО4 и сильным основанием КОН. Гидролиз протекает по аниону:
РО43+HОН <=> НРО42-+ OH-. Среда щелочная, рН>7.
Молекулярное уравнение: К3 РO4+Н2O <=> К2Н РО4+КОН.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №2
растворы электролитов
опыт 1. Ознакомление с окраской индикаторов в различных средах
Окраска индикаторов:
| Название индикатора | Цвет индикатора в растворе: | ||
| нейтральном | кислом | щелочном | |
| Лакмус Метилоранж Фенолфталеин | Фиолетовый Оранжевый Бесцветный! | Красный Красный Бесцветный! | Синий Желтый Красный |
Какую окраску приобретает индикатор тимолфталеин:
HInd  H+ + Ind-
H+ + Ind-
(бесцветный) (синий)
а) в кислом растворе?
____________________________________________________________________________________________________________________________________________
б) в щелочном растворе?
____________________________________________________________________________________________________________________________________________
ОПЫТ 2. Гидролиз солей
Таблица наблюдений:
| Соль | Окраска индикатора | Реакция среды | 7  рН рН 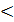 7? 7?
| Какими основанием и кислотой образована соль (слабым? сильным?) |
| 1. Nа2СO3 | Н2СО3-... ……..кислота NаОН-.... … основание | |||
| 2. Аl2(SO4)3 | Н2SO4-.................кислота Al(OH)3-...... …….основание | |||
| 3. ВаСl2 | НСl-....... …. кислота Ва(ОH)2-...... … основание |
1. Ионно-молекулярное уравнение:
__________________________________________________________________________________________________________________________________________
Молекулярное уравнение:
________________________________________________________________________________________________________________________________________
2. Ионно-молекулярное уравнение:
________________________________________________________________________________________________________________________________________
Молекулярное уравнение:
________________________________________________________________________________________________________________________________________
Элементы теории, примеры зачетных задач
Гидроксиды, вступающие в реакцию нейтрализации:
а) только с кислотами, называются основными, например, NаОН, Ва(OН)2, Ni(OН)2;
б) только со щелочами - кислотными, например, SO2(0Н)2 (или в общепринятой форме записи - Н2SО4), NO2ОН (или НNО3);
в) и с кислотами, и со щелочами - амфотерными, например, Сr(ОН)3, Zn(ОН)2.
Пример 6. Напишите молекулярные и ионно-молекулярные уравнения: а) получения гидроксида хрома Сr(ОН)3; б) растворения его в кислотах; в) взаимодействия его с растворами и расплавами щелочей.
Решение
а) Молекулярные уравнения: Сr2(SO4)3+6КOН=2Сr(OН)3↓+3К2SO4, Сr(NО3)3+3КОН=Сr(ОН)3↓+3КNО3 или СrСl3+3КОН=Сr(ОН)3↓+3КСl
Ионно-молекулярное уравнение: Сr3++3OH-= Сr(ОН)3↓
б) Сr(OН)з+3НСl=СrСl3+3Н2O или 2Сr(OН)3+3Н2SO4=Сr2(SO4)3 +6Н2O
Сr(OН)3+3Н+=Сr3++ЗН2O.
в) С растворами: Сr(ОН)3+ЗNаОН=Nа3[Сr(ОН)6],
Сr(ОН)3+3OH=[Сr(ОН)6]3-
С расплавами: Сr(OН)3+NаOН=NаСrO2+2Н2O,
Сr(OН)3+OН=СrO2-+2Н2O
---------------------------------------------------------------------------------------------------------
Окислительно-восстановительные реакции (ОВР) - это реакции, сопровождающиеся передачей или смещением электронов от одних атомов к другим, в результате чего изменяются их степени окисления.
Степень окисления (СО) - это условный заряд атома в молекуле, вычисленный из предположения, что молекула состоит только из ионов. Атом более электроотрицательного элемента в соединении имеет отрицательную СО, а менее электроотрицательного - положительную. Для простых веществ СО равна нулю (O2, Н2, Zn и др.). В соединениях постоянные степени окисления проявляют: F-1, O-2
+2 -1 -1 +1 -1 +2 -1
(кроме OF2; H2O2; Na2O2 и т.п.), H+1 (кроме гидридов K H; Ca H2 и т.п.), металлы IA – подгруппы – Me+1, металлы IIA- подгруппы – Me+2.
3. Ионно-молекулярное уравнение:
______________________________________________________________________
Молекулярное уравнение:
______________________________________________________________________
Опыт 3. Определение характера гидроксидов и металлов
Получение гидроксидов (молекулярные и ионно-молекулярные уравнения):
MgSO4 + ….NaOH = ……..…………………………………………………………….
…………………………………………………………………………………………..
Al2(SO4)3 + ….NaOH =……………………………………………………………….
…………………………………………………………………………………………..
Pb(NO3)2 + …..NaOH = ………………………………………………………………..
……………………………………………………………………………………………
Результаты опытов:
| Гидроксиды | Растворимость: | Характер гидроксида | |
| в кислотах | в щелочах | ||
| Мg(ОН)2 | |||
| Аl(ОН)3 | |||
| Рb(ОН)2 |
Растворение в кислотах (молекулярные ионно-молекулярные уравнения):
Мg(ОН)2↓+…HNO3 = ……………………………………………………………………
…………………………………………………………………………………………….
Аl(ОН)3↓+…HNO3 = ……………………………………………………………………
…………………………………………………………………………………………….
Рb(ОН)2↓+…HNO3 = ……………………………………………………………………
…………………………………………………………………………………………….
Растворение амфотерных гидроксидов в щелочах (молекулярные и ионно-молекулярные уравнения)
Мg(ОН)2↓+….NaOH = ……..…………………………………………………………….
…………………………………………………………………………………………..
Аl(ОН)3↓+….NaOH = ……..…………………………………………………………….
…………………………………………………………………………………………..
Рb(ОН)2↓+….NaOH = ……..…………………………………………………………….
…………………………………………………………………………………………..
Дата: Подпись преподавателя
Элементы теории, примеры зачетных задач
Неизвестные СО рассчитываются из условия, что сумма СО всех атомов в молекуле равна нулю, а в сложном ионе - заряду этого иона.
Пример 7. Рассчитать СО: а) хрома в дихромате калия; б) фосфора в гидрофосфат-ионе.
Решение
+1 Х1 -2 +1 Х2 -2
Обозначим СО атомов: а) К2Сr2О7; б) НРО4 2- Составим и решим уравнения баланса заряда: а) 2•1+2•Х1+7•(-2)=0; Х1=+6; б) 1+Х2+4•(-2)=-2; Х2=+5.
Окисление - это процесс повышения степени окисления. Окисляющиеся атомы, молекулы или ионы называются восстановителями. Они в процессе окисления отдают электроны.
Восстановление - это процесс понижения степени окисления. Восстанавливающиеся атомы, молекулы или ионы называются окислителями. Они в процессе окисления принимают электроны.
Атом элемента в высшей степени окисления может лишь принимать электроны, т.е. проявляет только окислительные свойства. Атом элемента в низшей степени окисления может их лишь отдавать и проявляет только восстановительные свойства. Атом элемента в промежуточной степень окисления может проявлять как восстановительные свойства (с сильными окислителями), так и окислительные свойства (с сильными восстановителями).
Пример 8. Напишите электронную формулу азота. Приведите примеры соединений в высшей, низшей и промежуточной СО.
Решение
7N 1s2 2s2 2р3
Азот может отдать не более 5 валентных электронов (подчеркнуты) и принять до устойчивой конфигурации 2s22р6 три электрона. Высшая СО = +5 (НNО3, N2О5 - только окислители). Низшая СО = -3 (NН3, NН4Сl - только восстановители). Промежуточная СО, например, +3 (КNO2 - и окислитель, и восстановитель).
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 3
окислительно-восстановительные реакции (овр).
электрохимия
опыт 1. Окислительные и восстановительные свойства сернистой
кислоты
а) Уравнение реакции: H2SO3 + …H2S = ….S↓ + ….H2O
Электронные уравнения:
________________________________________________- процесс восстановления;
_________________________________________________- процесс окисления.
Окислитель -………..восстановитель -……………….
б) Уравнение реакции:...Н2SOз +...I2 +... Н2O =... Н2SО4 + ….HI
Электронные уравнения:
________________________________________________- процесс восстановления;
________________________________________________- процесс окисления.
Окислитель -........................ восстановитель -……………....
S находится в группе периодической системы. Высшая степень окисления ее - ……, низшая -…... Степень окисления S в Н2SО3 -
Выводы…………………………………………………………………………….
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
опыт 2. Взаимодействие азотной кислоты с медью
а) Схема взаимодействия концентрированной НNОз с металлами:
HNОз + Ме => NO2 ↑+ Мe(NO3)п + Н2O
(Здесь и в Опыте 2(б) при составлении уравнений реакций учтите, что НNO3 расходуется не только на окисление металла, но и на образование соли Ме(NO3)n)
Элементы теории, примеры зачетных задач
Для составления ОВР наиболее простым является метод электронного баланса. В этом методе рассматривается перераспределение электронов между гипотетическими ионами, заряд которых равен соответствующим степеням окисления. Сущность метода электронного баланса состоит в том, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Пример 9. ОВР протекает по схеме:
Nа2SO3 + К2Сr2O7 + Н2SO4 ®Nа2SO4 + Сr2(SO4)3 + К2SO4 + Н2O.
Укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнении реакции.
Решение
В схеме реакции расставим изменяющиеся СО:
+4 +6 +6 +3
Nа2SO3 + К2Сr2O7 + Н2SO4 ®Nа2SO4 + Сr2(SO4)3 + К2SO4 + Н2O.
Определим характер процессов:
S+4 ® S+6 - увеличение СО; процесс окисления;
Сr+6 ® Сr+3 - уменьшение СО; процесс восстановления.
S+4 (Nа2SO3) - восстановитель, Сr+6(К2Сr2O7) - окислитель.
Составляем электронные уравнения:
S+4 - 2ē = S+6 - процесс окисления;
Сr+6 + Зē = Сr+3 - процесс восстановления.
Поскольку число электронов, отдаваемых восстановителем, должно равняться числу электронов, принимаемых окислителем, умножим электронные уравнения на соответствующие коэффициенты:
3| S+4 - 2ē = S+6
2 | Сr+6 + 3ē = Сr+3
Подставляем эти коэффициенты в схему реакции:
3Nа2SO3 + К2Сr2O7 + Н2SO4 ®3Nа2SO4 + Сr2(SO4)3 + К2SO4 + Н2O.
Находим подбором и расставляем остальные коэффициенты:
3Nа2SO3 + К2Сr2O7 + 4Н2SO4 ®3Nа2SO4 + Сr2(SO4)3 + К2SO4 + 4Н2O.
Окончательная проверка правильности написания уравнения проводится по балансу атомов кислорода: 3•3+7+4•4 = 3•4+4•3+4+4;
32 = 32
Уравнение реакции:...HNO3(конц) +.... Cu = ………………………………
Электронные уравнения:
________________________________________________- процесс восстановления;
________________________________________________- процесс окисления.
Окислитель -........................ восстановитель -……………....
б) Схема взаимодействия разбавленной НNО3 с металлами:
НNО3 + Me => 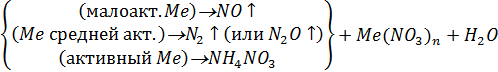
Уравнение реакции:...HNO3(разб) +.... Cu = ……………………………………
Электронные уравнения:
________________________________________________- процесс восстановления;
________________________________________________- процесс окисления.
Окислитель -........................ восстановитель -……………....
Выводы:
Какой элемент в HNO3 является окислителем? Укажите степень его окисления……….
Почему HNO3 проявляет только окислительные свойства?................................................................................................................................
Может ли при восстановлении НNО3 выделяться Н2?
опыт 3. Медно-цинковый гальванический элемент
Схема гальванического элемента:
(-)………|…………………..||…………….|…………(+)
E0Cu2+/Cu=……B; E0 Zn2+/Zn=………B; C (Cu2+) = C(Zn2+) = 1 моль/л
Процессы на электродах:
(A)……………………………………………. – процесс …………………..
(K)…………………………………………… - процесс ……………………
……………………………………………….. – ионно-молек. уравнение
……………………………………………….. – молекулярное уравнение
ЭДС = E(+) – E(-) = ………………………………………………………………..
Элементы теории, примеры зачетных задач
Устройства, в которых энергия химической реакции выделяется в виде электрической, называются гальваническими элементами.
Пример 10. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого: Ni | NiSO4|| СuSO4| Сu, если С(Сu2+)=С(Ni2+)=1 моль/л
Вычислите величину электродвижущей силы (ЭДС).
Решение
При концентрациях ионов металлов, равных 1 моль/л, на металлических электродах устанавливаются стандартные электродные потенциалы: Е°Сu2+/Сu =+0,34В; Е°Ni2+/№ =- 0,25В
На электроде, имеющем меньший потенциал, происходит отдача электронов, т.е. окисление. Этот электрод называется анодом. Поскольку ЕNi2+/Ni < ЕCu2+/Cu> анодом является никелевый электрод.
На электроде, имеющем больший потенциал, происходит принятие электронов, т.е. восстановление. Этот электрод называется катодом. Им является медый электрод.
Процессы, протекающие в гальваническом элементе:
Анод: Ni - 2ē = Ni2+
Катод: Сu2+ + 2ē = Сu
______________________________________________________________________
Ионно-молекулярное уравнение: Ni + Сu2+ = Ni2+ + Сu;
Молекулярное уравнение: Ni + СuSO4= NiSO4+Сu.
ЭДС=Е(Кат)-Е(Ан) = 0,34 - (-0,25) = 0,59 В.
----------------------------------------------------------------------------------------------------------
Коррозией называется самопроизвольный процесс разрушения металлов и сплавов в результате их окисления окружающей средой.
Поскольку коррозия является окислительно-восстановительным процессом, вероятность ее протекания тем больше, чем больше разность потенциалов систем окислителя и восстановителя, Еок-Евосст, т.е. чем больше алгебраическое значение Еок и меньше Евосст - Восстановителем при коррозии является металл. Корродировать в первую очередь будет более активный металл, имеющий меньший потенциал. Окислителем (деполяризатором) в процессе коррозии выступает тот компонент окружающей среды, который имеет больший потенциал.
опыт 4. Защитные свойства металлических покрытий
Качественная реакция на ион Fе 2+:
3 Fе2+ +2[Fе(СN)6]3- = Fе3[Fе(СN)6]2↓ (синий)
При коррозии с каким покрытием железа - цинковым или оловянным (луженым) - качественной реакцией открыт ион Fе2+?
…………………………………………………………………………………………..
а) Оцинкованное железо.
Соотношение потенциалов: (Е°Fе2+/Fе =…................... В)……………(Е°Zn2+/Zn =............................................................ ………В),
следовательно, анод -........... …….., катод -…………. Процессы:
(А)..................... ………………......................... - процесс
(К)......................................... ……………….….- процесс
..................................................... ………………………ионно-молек. уравнение
........................................................ …………………..- молекулярное уравнение
б) Луженое железо.
Соотношение потенциалов: (Е°Fе2+/Fе =... В)................. (Е°Sn2+/Sn = ……В),
следовательно, анод -..........., катод -................. Процессы:
(А).................................. ……………............................... - процесс
(К)......................................... ……………………………- процесс
........................................................ - ионно-молек. уравнение
....................................................... - молекулярное уравнение
Выводы:
Какое из покрытий катодное, какое - анодное?.....................
Какое покрытие более надежное?.........................
Какое покрытие при хорошем качестве более долговечно?.
опыт 5. Электролиз раствора иодида калия
|


|
 Е° K+/K = ….B
Е° K+/K = ….B
 | |||
|
 Е°2H2O/H2= - 0,41B
Е°2H2O/H2= - 0,41B
На катоде (-) протекает процесс восстановления, характеризующийся большим потенциалом: ………………………………………………………………………….
Элементы теории, примеры зачетных задач
Пример 11. Какие процессы будут протекать при коррозии луженой (покрытой оловом) меди в месте нарушения покрытия? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии в следующих средах: а) во влажном воздухе; б) в растворе хлороводородной кислоты.
Решение
Более активным восстановителем является олово, т.к. Е0Sn2+/Sn = - 0,14В < Е°Cu2+/Cu = +0.34 В, поэтому, в первую очередь, корродирует олово. Покрытие анодное.
а) Во влажном воздухе окислителем является кислород. Олово (анод) будет окисляться, а на меди (катоде) будет восстанавливаться кислород:
(А) Sn-2е = Sn2+ |2
(К) O2+4е+2Н2O=4OH- | 1
2Sn+O2+2Н2O=2Sn(OН)2↓
Продуктом коррозии является труднорастворимый гидроксид олова.
б) Несмотря на то, что потенциал кислорода больше, чем иона водорода в растворе кислоты, доступ кислорода к поверхности катода (меди) ограничен из-за его малой растворимости и медленной диффузии. В кислом растворе Еокис- Е°2Н+/Н2= 0 В > Евосст=Е°Sn2+/ Sn = -0,14 В и окислителем является ион водорода. Уравнения процессов:
(А) Sn -2е = Sn2+
(К) 2Н++2е = Н2
Sn + 2Н+ = Sn2+ + Н2, или Sn + 2НСl = SnСl2 + Н2.
Электролиз - это совокупность процессов раздельного окисления и восстановления на электродах, осуществляемых в растворах или расплавах электролитов за счет протекания через них постоянного электрического тока от внешнего' источника. В отличие от гальванического элемента при электролизе катод заряжен отрицательно, а анод - положительно.
На катоде протекают процессы восстановления, поэтому в первую очередь восстанавливаются наиболее сильные окислители, то есть катионы, имеющие в данных условиях больший потенциал.
На аноде (+) протекает процесс окисления, характеризующийся меньшим потенциалом: …………………………………………………………………….
У какого электрода наблюдается буро-желтое окрашивание?
У какого электрода обнаружена щелочная среда? Почему?
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
опыт 6. Электролиз раствора сульфата меди
а) с угольным анодом:
| |||
 |
|
 (-)
(-)
 Е° Cu2+/Cu = ….B
Е° Cu2+/Cu = ….B
 | |||
|
 Е°2H2O/H2= - 0,41B
Е°2H2O/H2= - 0,41B
Процесс на катоде: (-).... *.........
Процесс на аноде:(+)........тт.....
(На аноде окисление серы в 8О42" - ионе невозможно, т.к. степень окисления серы в нем высшая,+6).
б) с медным анодом:
| |||
 | |||

|
 Е° Cu2+/Cu = ….B
Е° Cu2+/Cu = ….B
 | |||
|
|
 Е°2H2O/H2= - 0,41B
Е°2H2O/H2= - 0,41B

Процесс на катоде: (-). …………………………………………………
На аноде протекает процесс окисления, характеризующийся меньшим потенциалом: (+)……………………………………………………………………………….
Дата: Подпись преподавателя:
Элементы теории, примеры зачетных задач
На аноде протекают процессы окисления, поэтому в первую очередь окисляются наиболее сильные восстановители, имеющие в данных условиях меньший потенциал.
Пример 12. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора К2SО4 в электролизерах:
а) с угольными электродами; б) с висмутовыми электродами.
Решение
а) На катоде в первую очередь протекает восстановление наиболее сильных окислителей, характеризующихся большим потенциалом. К отрицательно заряженному катоду движутся катионы К+, которые могли бы восстанавливаться до металлического калия (Е0к+/к:=-2,92В), и полярные молекулы воды, которые могли бы восстанавливаться до водорода (Е°2H+/Н2=0,00В при рН=0; Е02Н2O/Н2=- 0,41В при рН=7). Поскольку Е2H+/H2> Е0K+/K= то на катоде восстанавливается вода: 2Н20 + 2е= Н2+2OН-
К положительно заряженному аноду движутся анионы SО42- и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс - окисление воды до кислорода:
2Н2O - 4е = O2 + 4H+.
б) На висмутовом аноде кроме окисления воды возможно окисление висмута - материала анода. На аноде протекает, в первую очередь, окисление наиболее сильных восстановителей, характеризующихся меньшим потенциалом. Поскольку Е0Bi3+/Bi= +0,22 В В < Е о2/н2O=+1,23 В, то окисляться будет материал анода: Вi-3е = Вi3+.
В растворе появляются ионы Вi3+. Они и восстанавливаются на катоде, так как их потенциал больше, чем потенциал иона калия или иона водорода из воды: Вi3+ + 3е = Вi
________________________________________________________________________
Комплексными называются такие соединения, в узлах кристаллической решетки которых находятся сложные комплексные ионы (комплексы), способные к самостоятельному существованию в растворе.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №4
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.
СВОЙСТВА СОЕДИНЕНИЙ d ЭЛЕМЕНТОВ
ОПЫТ 1. Диссоциация комплексных и двойных солей
Качественная реакция иона Fе3+: Fе 3+ + 3SCN- = Fе(SCN)3 (красный).
В растворе какой соли – NH4Fe(SO4)<