COVID-19 отнесен к перечню особо опасных инфекционных заболеваний, и государство в целях ограничения его распространения и охраны здоровья граждан реализует мероприятия по иммунопрофилактике граждан.
В настоящее время в России проводится массовая вакцинация населения от COVID-19.
Актуальным представляется вопрос о применяемых вакцинах от новой коронавирусной инфекции.
Вакцина – это лекарственный препарат, который вводится человеку для выработки его организмом активного иммунитета к одному или нескольким конкретным заболеваниям.
Вопросы, связанные с разработкой и последующим обращением лекарственных средств в Российской федерации, регулирует одноименный Федеральный закон № 61 от 12.04.2010 «Об обращении лекарственных средств» (далее ФЗ № 61)
Согласно ст. 13 ФЗ № 61 в Российской Федерации допускается применение лекарственных средств, если они зарегистрированы соответствующим уполномоченным федеральным органом исполнительной власти. Таким уполномоченным органом является Минздрав РФ.
Федеральным законом от 01.04.2020 N 98-ФЗ внесены изменения в ст. 13 ФЗ № 61, согласно которым государственная регистрация лекарственных препаратов, которые предназначены для применения в условиях профилактики и лечения заболеваний, представляющих опасность для окружающих и которые разработаны в том числе по заданию федеральных органов исполнительной власти, уполномоченных в области обороны страны и безопасности государства, осуществляется в порядке, установленном Правительством Российской Федерации.
Правительством РФ издано Постановление от 03.04.2020 N 441 "Об особенностях обращения лекарственных препаратов для медицинского применения, которые предназначены для профилактики и лечения заболеваний, представляющих опасность для окружающих… », устанавливающее беспрецедентный упрощенный порядок регистрации таких лекарственных средств. На основании п. 4 указанного Постановления допускается государственная регистрация лекарственного препарата при представлении не в полном объеме документов, указанных в подпункте "т" пункта 3 настоящего документа, то есть отсутствие отчетов о результатах клинических исследований лекарственного препарата. В этом случае требуется представление результатов достаточного объема проведенных доклинических исследований ( если положительные результаты применения препарата достигнуты в опытах над несколькими видами животных, в том числе на одном крупном виде, причем они однозначно и явно связаны с ожидаемым положительным эффектом действующего вещества).
Главное отличие клинического испытания от доклинического исследования заключается в том, что испытуемыми являются не животные, а люди. То есть указанный документ узаконил возможность регистрации и ведения в оборот новых вакцин от коронавируса без прохождения всех стадий клинических исследований на людях.
На следующей схеме представлен общий порядок разработки и введения в оборот лекарственных средств (для сравнения читающим, где ДКИ – доклинические исследования, КИ – клинические исследования)
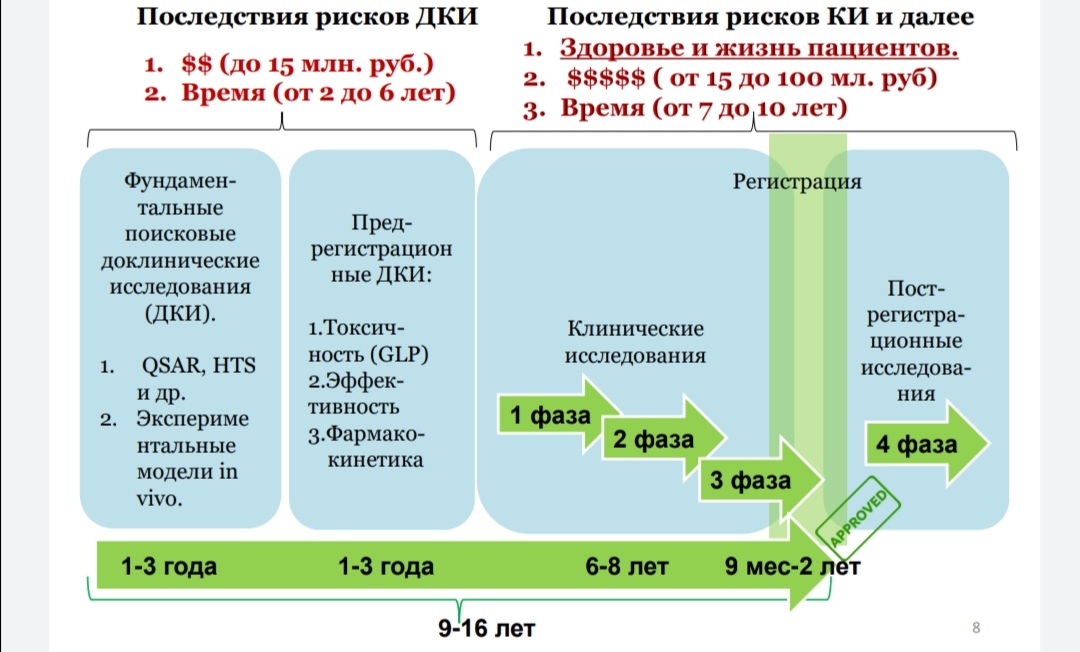
Схема показывает, что после проведения регулируемых доклинических исследований на животных, получается разрешение на проведение клинических исследований лекарственного препарата на людях, которые занимают несколько лет. Понятие и цели проведения клинических исследований перечислены в ст. 38 ФЗ № 61. Общим словами, цель клинических исследований - оценка терапевтической или профилактической эффективности и переносимости нового лекарственного средства, установление наиболее рациональных доз и разработка схем его применения, сравнение с уже существующими препаратами.
Выделяют четыре фазы клинических испытаний, из которых три являются обязательными для того, чтобы новый препарат в принципе разрешили применять у человека (то есть зарегистрировали, произвели и отправили в оборот):
Фаза I. Цель этапа — убедиться, что препарат можно применять у людей. Самыми первыми препарат «пробуют» люди из небольшой группы здоровых добровольцев.
Фаза II. Цель этапа — выяснить, работает ли препарат на заболевших. На этой стадии участвуют до 300 пациентов с заболеванием, для лечения которого предполагается применять исследуемый препарат. Длится вторая фаза от нескольких месяцев до двух лет.Результаты II фазы клинических испытаний позволяют сделать только предварительные выводы об эффективности лекарства. Чтобы сделать окончательный вывод об эффективности и безопасности нового лекарства, нужно больше участников и времени.
Фаза III. Цель этапа — провести исследования на большой (расширенной группе) и оценить действие нового препарата в сравнении с другими. На этой фазе уже используют двойные слепые испытания и оценивают вероятность регистрации препарата.
Фаза IV называется пострегистрационной — этот этап клинического испытания начинается, когда готовое лекарство уже поступает в продажу и позволяет выявить краткосрочные и долгосрочные побочные эффекты и редкие противопоказания.
Клинические исследования лекарственного препарата для медицинского применения согласно ст. 38 ФЗ № 61 проводятся на основании разрешения на проведение клинического исследования лекарственного препарата, выданного уполномоченным федеральным органом исполнительной власти, то есть Минздравом, который ведет реестр выданных разрешений на проведение клинических исследований лекарственного препарата, содержащий указание на их цель или цели.
Согласно информации из реестра Минздрава зарегистрированная им и широко применяемая вакцина Спутник V в настоящее время проходит клинические испытания.
Ниже приведены выдержки из Реестра Минздрава (grls.rosminzdrav.ru).
Гам-KOBИД-Вак (Спутник V). I-II стадии исследований проводились с 16.06.20 по 31.12.20 на 43 добровольцах в возрасте 18+. С 25.08.20 проводятся III-IV стадии исследований на 40.000 добровольцах в возрасте 18+ (части из которых ставят не вакцину, а плацебо). Цель исследований - ОЦЕНКА БЕЗОПАСНОСТИ, эффективности и иммуногенности вакцины. Окончание исследований 31.12.22.
Гам-KOBИД-Вак (Спутник V). С 13.10.20 проводятся III-IV стадии исследований на 150 добровольцах в возрасте 60+. Цель исследований - ИЗУЧЕНИЕ БЕЗОПАСНОСТИ, переносимости и иммуногенности препарата. Окончание исследований 31.12.21.
Гам-KOBИД-Вак-М (Спутник V). С 02.07.21 проводятся I-II стадии исследований на 3.660 добровольцах-подростках. Цель исследований - ОЦЕНКА БЕЗОПАСНОСТИ, переносимости и иммуногенности препарата. Окончание исследований 31.12.23.
Гам-KOBИД-Вак (Спутник V). Спрей назальный. С 12.10.21 проводится II стадия исследований на 500 добровольцах в возрасте 18+. Цель исследований - ОЦЕНКА БЕЗОПАСНОСТИ, переносимости и иммуногенности препарата. Окончание исследований 31.12.23.
Ни одна версия «Спутника» не прошла всех стадий клинических исследований НА ПРЕДМЕТ ЕГО ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ для людей. Даже для взрослых.. На сегодняшний день стандартом испытаний для финального доказательства безопасности и эффективности лекарственного средства является рандомизированное, двойное слепое, контролируемое клиническое исследование. Только такой эксперимент позволяет достоверно установить, что между приемом лекарства и выздоровлением существует причинно-следственная связь. Такие исследования на расширенной группе проводятся на III стадии, их результаты не представлены в настоящее время.
В инструкции к Спутнику прямо указано, что данная вакцина зарегистрирована по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Описание подготовлено на основании ограниченного объема клинических данных по применению и будет дополняться по мере поступления новых данных.