1. Рассчитайте изменение энтропии, энтальпии и энергии Гиббса при с.у. для реакции гидролиза мочевины СО(NН2)2(ж) + Н2О(ж) = СО2(ж) + 2 NН3(ж).
2. Рассчитайте изменение энтропии, энтальпии и энергии Гиббса реакции образования глицилглицина 2 СН2(NН2)СООН(ж) → СН2(NН2)СОNНСН2СООН(ж) + Н2О(ж) при 298К.
3. Для реакции 2 NO2(г) ↔ N2О4(г) вычислите ΔG°р-ции и температуру, при которой оба направления процесса равновероятны.
4. Рассчитайте изменение энтропии, энтальпии и энергии Гиббса реакции окисления этанола в уксусный альдегид С2Н5ОН(ж) + О2(г) ↔ СН3СНО(г) + Н2О(ж) при с. у.
5. Глицерин – один из продуктов метаболизма, который окончательно превращается в организме в СО2(г) и Н2О(ж). Рассчитайте изменение энтропии, энтальпии и энергии Гиббса для этой реакции при 298 К.
6. РеакциейС6Н12О6(ж) → С3Н7СООН(ж) + 2 СО2(г) + 2Н2(г) выражается один из путей метаболизма глюкозы. Рассчитайте изменение энтропии, энтальпии и энергии Гиббса для этой реакции при с. у..
7. Рассчитайте изменение энтропии, энтальпии и энергии Гиббса при с.у. для реакции СО(г) + Сl2(г) ↔ СОСl2(г)
8. Рассчитайте изменение энтропии, энтальпии и энергии Гиббса для реакции фотосинтеза, протекающей в организме: 6 СО2(г) + 6 Н2О(ж) ↔ С6Н12О6(ж) + 6О2(г) при 298 К.
9. Вычислите среднюю скорость реакции А → В, если начальная концентрация исходного вещества 6 моль/л, а через 2 мин – 2 моль/л.
10. Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергия активации (Ea) уменьшить на 4 кДж/моль?
11. Вычислите энергию активации в указанном интервале температур, если константа скорости разложения оксида азота (V) при 35 оС равна 8,76·10-3 мин-1, а при 45оС увеличивается до 2,99·10-2 мин-1.
12. При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий -192. Рассчитайте, какая часть введенного радионуклида останется в опухоли через 10 суток, если его период полупревращения составляет 74,08 суток.
13. Вычислите температурный коэффициент константы скорости разложения пероксида водорода в температурном интервале 25-55оС при Ea = 75, 4 кДж/моль.
14. Как измениться скорость прямой реакции: 2 СО(г) + О2(г)↔ 2 СО2(г) при увеличении концентрации СО в 3 раза?
15. Константа скорости распада пенициллина при 36 оС равна 6·10-6 с-1, а при 41 оС она составляет 1,2·10-5 с-1. Вычислите температурный коэффициент реакции.
16. Женщина, «соблюдающая фигуру», съела вне плана в составе торта 180 г глюкозы. Считать, что глюкоза полностью окисляется в организме по уравнению:
С6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж)
Какое количество энергии получит организм пациентки? Какое время пациентка должна затратить на ручную стирку белья или окучивание грядок (расход энергии 543 кДж/ч), чтобы компенсировать излишества?
17. Мужчина, «следящий за фигурой», выпил на вечеринке водки в пересчете на абсолютный спирт 46 г этанола С2Н5ОН. Считать, что этанол полностью окисляется в организме по уравнению: С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж)
Какое количество энергии получит организм пациента? Какое время мужчина должен бегать трусцой (расход энергии 920 кДж/ч), чтобы компенсировать излишества?
18. Инспектор ГИБДД остановил водителя и по его внешнему виду заподозрил, что тот находится в состоянии алкогольного опьянения. Анализ, проведенный в токсикологической клинике, показал, что содержание этилового спирта в крови водителя превышает допустимую норму. Однако водитель утверждает, что алкогольных напитков не употреблял в течение нескольких дней. При выполнении профессиональных обязанностей ему приходится много времени проводить в условиях повышенной концентрации выхлопных газов и он считает, что в его организме спирт мог образоваться из CO2 и H2O. Рассчитать DGºреакции. Может ли происходить в организме человека самопроизвольное образование C2H5OH из CO2 и H2O?
19.Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция: СО2 (г)+Н2 (г)↔ СО(г)+Н2О (ж)? Рассчитайте ΔG данной реакции. При каких температурах данная реакция становится самопроизвольной?
20. Рассчитайте тепловой эффект реакции горения сероводорода.
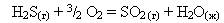
Возможно ли самопроизвольное протекании данного процесса при стандартных условиях?
21. В лаборатории создали новый лекарственный препарат. Срок годности этого препарата при tº = 20ºС составляет три года. Известно, что для данной реакции температурный коэффициент скорости реакции равен 2.Какое время можно хранить препарат при 30ºС, 40ºС, 50ºС? Можно ли проводить исследования при температурах 100-200ºС?
22. Атмосферные загрязнения постепенно уничтожают защитный озоновый слой Земли. Озоновому слою угрожают поступающие в атмосферу фторированные и хлорированные углеводороды - фреоны, например, CCl3F, CCl2F2, CClF3. Они химически стабильны в нижних слоях атмосферы, но в стратосфере под действием ультрафиолетового излучения Солнца разрушаются, выделяя атомарный хлор, после чего начинают протекать реакции взаимодействия атомарного хлора с озоном. Рассчитайте скорость такой реакции с образованием кислорода и монооксида хлора, если через 15 сек после начала реакции молярная концентрация озона была 0,3 моль/л, а через 35 сек (от начала реакции) стала равна 0,15 моль/л.
23. Диоксид серы (SO2) – самый распространенный загрязнитель воздуха. Он опасен для здоровья людей, особенно тех, кто страдает заболеваниями дыхательных путей. Диоксид серы снижает продуктивность сельскохозяйственных культур, замедляет рост леса, пагубно действует на строительные материалы, содержащие карбонат кальция. В атмосфере диоксид серы окисляется до SO3; при этом роль катализатора играет находящаяся в воздухе пыль оксидов металлов. Капли влаги превращают SO3 в серную кислоту, которая вместе с атмосферными осадками выпадает в виде "кислотных дождей". Рассчитайте значение константы скорости реакции диоксида серы с атомарным кислородом, если при концентрациях С (SO2) и С (O), равных соответственно 0,25 и 0,6 моль/л, скорость реакции равна 0,003 моль/(л·с).
24. Ферментативная реакция дегидрирования пропанола-2 протекает по уравнению: СНзСНОНСНз (р-р) ® СНзСОСНз (р-р) + Н2(г). Определите тепловой эффект этой реакции по теплотам сгорания: DН0сгор (СН3СНОНСН3) = -2002 кДж/моль; DН0сгор (СН3СОСН3) = -1789 кДж/моль; DН0сгор(Н2) = -285 кДж/моль.
25. Вычислите энергию Гиббса тепловой денатурации трипсина при 500С, если при 250С ∆Нореак = 283 кДж/моль, а ∆Sообр, 298 = 288 Дж/(моль∙К). Считать, что изменение энтальпии и энтропии не зависят от температуры в данном диапазоне.
Решение контрольного задания:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________