Для построения кривых изобар необходимо определить крайние точки кривых, т. е. температуры кипения HKK и ВКК при заданном давлении в колонне  .
.
Уравнение Антуана:

где  давление насыщенных паров;
давление насыщенных паров;
 - константы Антуана;
- константы Антуана;
Представим эту формулу в следующем виде (1) и рассчитаем  ,
,  . Коэффициенты
. Коэффициенты  подберём из таблицы 1.
подберём из таблицы 1.
Таблица 1 – значения 
 М для бензола и толуола.
М для бензола и толуола.
| A | B | C | 
| M | |
| Бензол(1) | 4.03129 | 1214,65 | 221,205 | 0,8790 | |
| Толуол(2) | 4.07427 | 1345,09 | 219,516 | 0,8669 |

Бензол 
Толуол 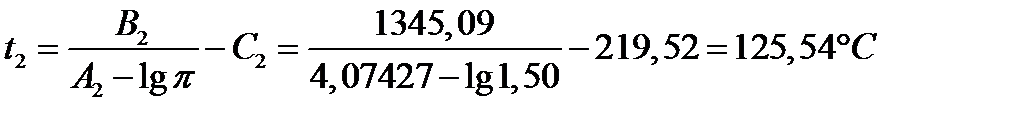
Полученный интервал температур кипения разбиваем на 6 примерно равных интервалов, и при данных температурах рассчитываются давления насыщенных паров компонентов P1 и Р2 по следующему уравнению:

1) 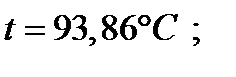
2) 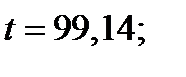
3) 
4) 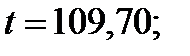
5) 
6) 
7) 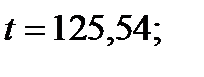












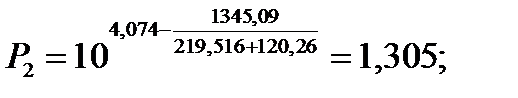

По этим точкам строим график зависимости давления насыщенных паров от температуры.
Построение х-у диаграммы, кривых изобар пара и жидкости.
Для этого определяем мольные доли НКК в жидкой фазе и равновесной паровой фазе, используя следующие уравнения:
 и
и 
1)
2)
3)
4)
5)
6)
7)




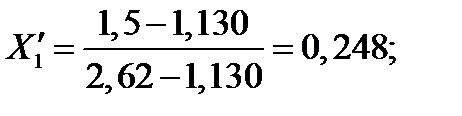

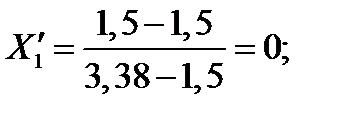

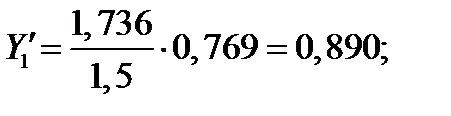

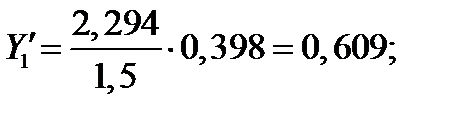



По значениям  ,
,  строим диаграммы х-у.
строим диаграммы х-у.
По значениям  ,
,  и t строим кривую изобары пара и жидкости.
и t строим кривую изобары пара и жидкости.
Построение энтальпильной диаграммы
Найдём значение энтальпии в исследуемых точках, используя следующее эмпирические уравнения:
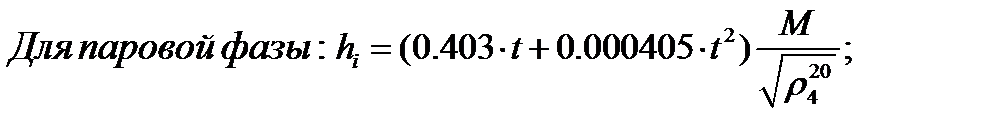



Для бензола:
Жидкая фаза:

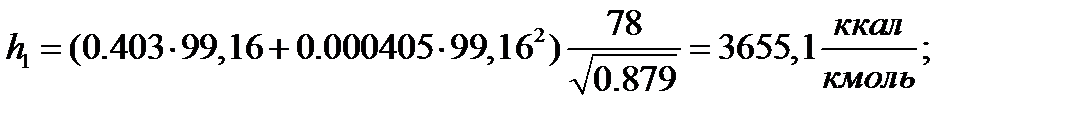

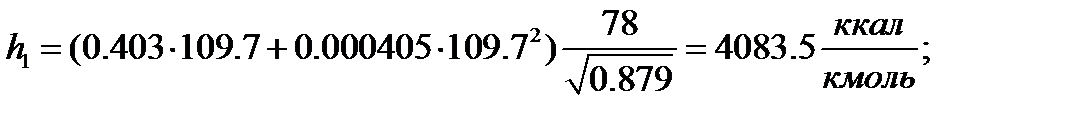



Паровая фаза:







Для толуола
Жидкая фаза:



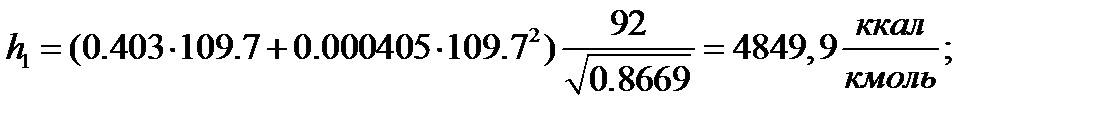

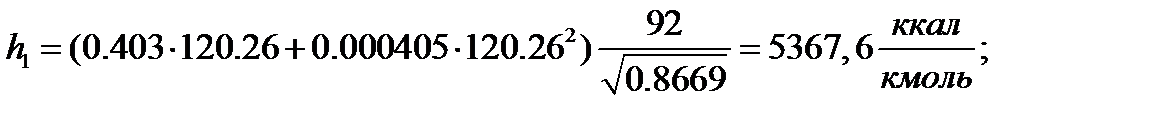

Паровая фаза:

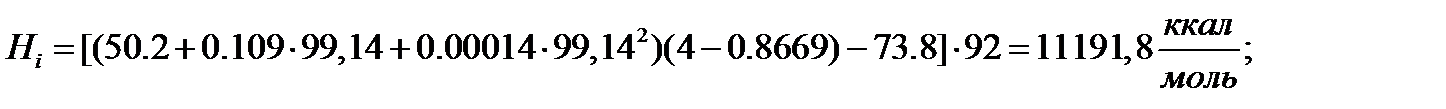





Для смеси:
Паровая фаза





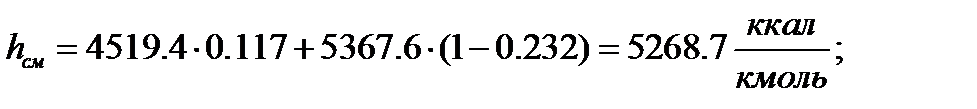

Жидкая фаза:



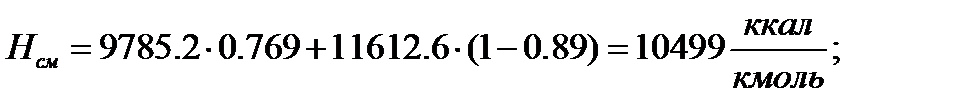

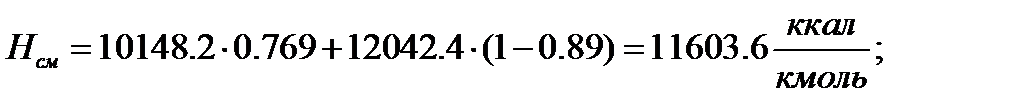
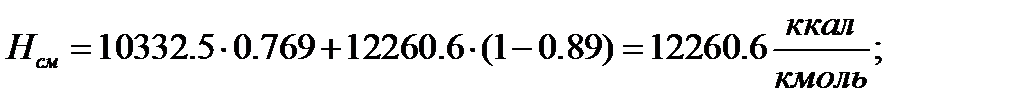
Все полученные результаты в этом пункте внесём в таблицу 2.
Таблица 2 – Результаты расчетов по пункту 3.1.
| Исслед. точки | Темпе- ратура ˚С | Давление насыщ. паров, Р1 | Давление насыщ. паров, Р2 | Мольная доля НКК в жидкой фазе, 
| Мольная доля НКК В паровой фазе, 
|
| 93,86 | 1,500 | 0,605 | 1,000 | 1,000 | |
| 99,14 | 1,736 | 0,713 | 0,769 | 0,890 | |
| 104,42 | 2,000 | 0,835 | 0,570 | 0,761 | |
| 109,70 | 2,294 | 0,974 | 0,398 | 0,609 | |
| 114,98 | 2,620 | 1,130 | 0,248 | 0,434 | |
| 120,26 | 2,980 | 1,305 | 0,117 | 0,232 | |
| 125,54 | 3,375 | 1,500 |
| Исслед. точки | Жидкая фаза | Паровая фаза | ||||
Энтальпия
бензола

| Энтальпия
толуола
| Энтальпия
смеси

| Энтальпия
бензола

| Энтальпия
толуола
| Энтальпия
смеси

| |
| 3443,8 | 4090,2 | 3443,8 | 9255,0 | 10984,8 | 9255,0 | |
| 3655,2 | 4341,2 | 3813,6 | 9429,8 | 11191,8 | 9623,3 | |
| 3868,4 | 4594,4 | 4180,3 | 9606,6 | 11401,1 | 10035,9 | |
| 4083,5 | 4849,9 | 4544,5 | 9785,2 | 11612,6 | 10499,0 | |
| 4300,5 | 5107,6 | 4907,1 | 9965,7 | 11826,3 | 11019,1 | |
| 4519,4 | 5367,6 | 5268,7 | 10148,2 | 12042,4 | 11603,6 | |
| 4740,1 | 5629,8 | 5629,8 | 10332,5 | 12260,6 | 12260,6 |
Расчет однократного испарения.
3.2.1. Расчет  и
и  .
.
Процесс однократного испарения проанализируем при помощи х-у диаграммы и изобары.
Найдем точки А и N на x-y диаграмме с помощью уравнения:

1) Пусть 



Это - точка т. А(0,76; 0) на диаграмме х-у.
2) Пусть 


Это - точка т. N(0,41; 0,41) на диаграмме х-у.
Пересечением продолжения линии AN и линией встречных равновесных потоков, находим точку, определяющий состав равновесной смеси:


3.2.2. Расчет равновесной температуры (tр).
Температура находиться по изобаре из t-x-y диаграммы.
Для этого в данной диаграмме находим точки  и
и  . И проводим по ним горизонтальную линию (изобару) и находим значение температуры:
. И проводим по ним горизонтальную линию (изобару) и находим значение температуры:

3.2.3. Проверка значения мольного доля отгона (е).
Проверка значения e осуществляется в сравнение исходного значения е и значения е, полученного с помощью правила рычага:

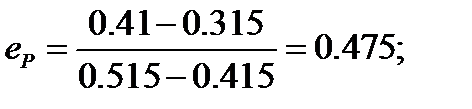

Проверка: 
Так как 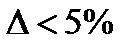 следовательно мы можем использовать значение
следовательно мы можем использовать значение  в дальнейших расчетах.
в дальнейших расчетах.