Тема 22. Спирты, альдегиды, кетоны
1. Замещение водорода на ион металла:
одноатомные реагируют только с активными металлами, многоатомные и фенолы – с металлами и их гидроксидами:
2R–CH2–OH + 2К® 2R–CH2–OК+ H2
Взаимодействие с гидроксидом меди (II) – качественная реакция на многоатомные спирты. Гидроксид меди – осадок голубого цвета растворяется в многоатомных спиртах с образованием ярко-синего раствора. Обычно используют так называемый свежеосажденный гидроксид меди, т.е. вначале в пробирке его получают из раствора медного купороса и щелочи
CuSO4 + 2NaOH = Cu(OH)2¯
Поэтому в ЕГЭ в реакции с многоатомными спиртами в качестве реагента могут указать как Cu(OH)2, так и вместе CuSO4, NaOH, но, обратите внимание! реакция идет в щелочной среде, без NaOH, с солями меди, данные реакции не идут.
Если рассматривать многоатомный спирт как многоосновную кислоту, то упрощенно можно записать
с этиленгликолем
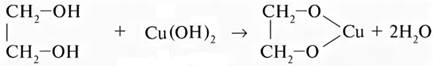
этиленгликоль гидроксид меди (II) гликолят меди (II)
голубой осадок ярко-синий раствор
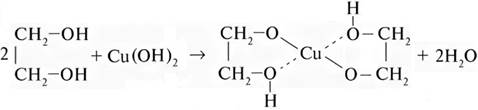
Реально образуются комплексные соединения, в которых ион меди (как d -металл, склонный к комплексообразованию) связывает две молекулы спирта
В сильнощелочной среде образуются комплексные соли натрия:
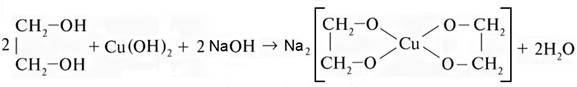
Аналогично идут глицерином и глюкозой, запишем только упрощенные схемы:
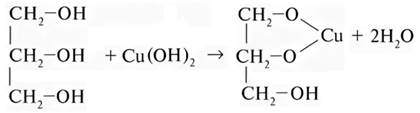
глицерин глицерат меди(II)
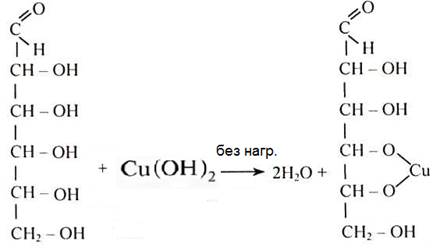
глюкоза глюконат меди(II)
Как известно из курса неорганической химии, соединения меди(II) могут быть окислителями и переходить в соединения меди(I), это их свойство часто используется в органической химии: надо запомнить, что СuO и Cu(OH)2 при нагревании мягкие – окислители. Поэтому, в случае глюкозы, которая является не только многоатомным спиртом, но и альдегидом, без нагревания идет образование глюконата меди (Cu(OH)2 проявляет только кислотно-основные свойства), а при нагревании глюкоза окисляется Cu(OH)2 до глюконовой кислоты (свойства глюкозы будут подробно рассмотрены в разделе углеводы).
Посмотрите видеоопыты
https://youtu.be/6jJ4ZPBvBUE
https://youtu.be/JorR3GUMF2o
2. Реакции спиртов с органическими и некоторыми минеральными кислотами (азотной, серной) с образованием сложных эфиров также идут с разрывом связи О–Н
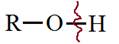
! Взаимодействие спиртов с кислотами с образованием сложных эфиров называется реакцией этерификации.
Реакции способствует кислая среда, поэтому при взаимодействии с карбоновыми кислотами к спирту добавляют концентрированную серную кислоту:
Надо отметить, что при этерификации от спирта отщепляется –Н, а от кислоты –ОН:
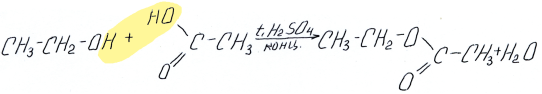
этиловый эфир уксусной кислоты
(этилацетат или этилэтаноат)
смотри видео
https://youtu.be/ic0ZS1zqn9Q
https://vk.com/video-70960743_170075540
Большое значение имеет образование сложных эфиров азотной кислоты
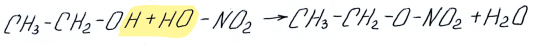
этилнитрат
Обратим внимание, что знаменитое вещество нитроглицерин это именно сложный эфир, а не нитросоединение
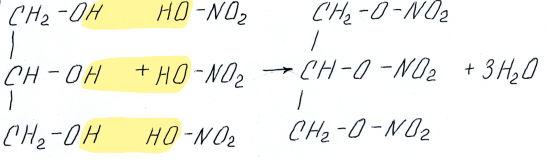
нитроглицерин
(глицеринтринитрат,
1,2,3-тринитроксипропан)
На основе нитроглицерина изготавливают взрывчатые вещества, например динамит.
Реакция этерификации имеет огромное значение в органической химии. Выше разобраны свойства спиртов, поэтому спирт написан на первом месте, однако удобнее эту реакцию писать, начиная с формулы кислоты, и на «ее основе» писать формулу сложного эфира, запишем в общем виде
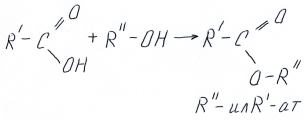
Напомним, что реакции с карбоновыми кислотами протекает в кислой среде и является обратимой – в щелочной среде сложные эфиры карбоновых кислот распадаются на спирт и кислоту (точнее соль этой кислоты, так как образующаяся кислота будет нейтрализована щелочью). Обратную реакцию подробно рассмотрим в разделе сложные эфиры.