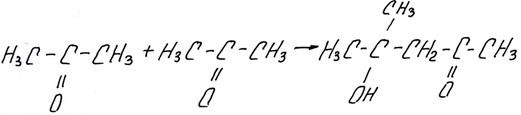По той же схеме альдегид может присоединить молекулу спирта (в кислой среде):
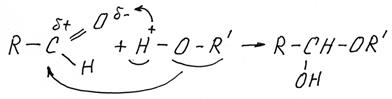
Образовавшееся вещество содержит при одном атоме углерода и гидроксильную группу (–ОН) и алкоксигруппу (от спирта –OR). Такие соединения называются полуацетали. Гидроксильная группа в полуацеталях очень подвижна и может в избытке спирта заменится на еще одну алкоксильную группу, образуется ацеталь:
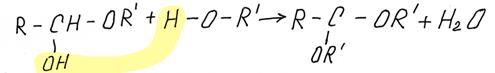
полуацеталь спирт ацеталь
Приведем пример:
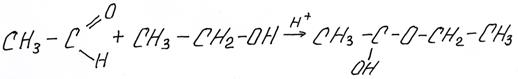
полуацеталь: 1-этоксиэтанол
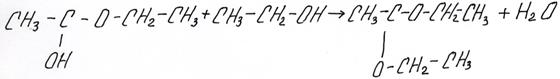
ацеталь: 1,1-диэтоксиэтан
3) Присоединение HCN – синильной или циановодородной кислоты.
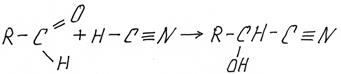
Образующееся соединение содержит две функциональные –ОН и –CºN, оно одновременно является и спиртом и нитрилом, такие соединения называют оксинитрилами.
Нитрилы это соединения вида
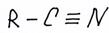
Отдельно мы их рассматривать не будем, но в ЕГЭ, в последнее время, стали встречаться задания с синтезом через нитрилы. При присоединении к органическому веществу группы –CºN удлиняется углеводородный радикал: образующееся вещество содержит на один атом больше, чем исходное. Сами же нитрилы гидролизуются водой, образуя карбоновую кислоту и аммиак, а в заданиях ЕГЭ – соль аммония.
Приведем гидролиз полученного выше оксинитрила
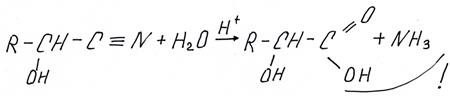
или более правильно в ЕГЭ
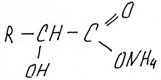
Приведем еще один пример синтеза через нитрилы, используя в качестве исходного вещества не альдегид, а галогенпроизводное
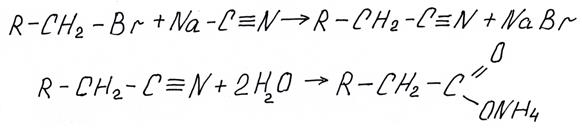
II Окисление альдегидов
Альдегиды легко окисляются до соответствующих кислот по схеме:
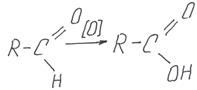
Формальдегид также окисляется до муравьиной кислоты, но именно эта простейшая карбоновая кислота сама содержит альдегидную группу (выделена на схеме), поэтому муравьиная кислота обычно окисляется дальше – до угольной кислоты, которую следует записывать в виде углекислого газа.
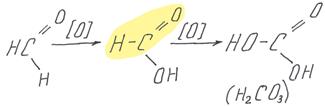
Альдегиды очень легко окисляются, причем не только традиционными растворами KMnO4 и K2Cr2O7 (к которыми реагируют многие классы органических веществ), но и значительно более слабыми. Качественными реакциями на альдегидную группу являются реакции с аммиачными растворами оксида серебра и гидроксидом меди (II).
Реакция серебряного зеркала – знаменитая органическая реакция альдегида с аммиачным раствором Ag2O, в которой восстановленное металлическое серебро оседает на стекле.
см. опыты
https://youtu.be/xtaH2zmR7IY
https://yandex.ru/efir?stream_id=4f917d1679a5357db821f2f82e408b0d&from_block=logo_partner_player
Так как образующаяся из альдегида кислота реагирует с избыточным аммиаком из раствора, ЕГЭ предписывает писать реакцию не в классическом виде (с образованием кислоты), а с образованием ее соли аммония:
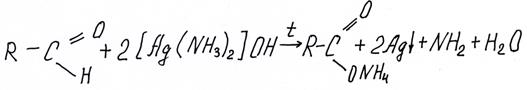
В случае формальдегида следует писать карбонат аммония.
Окисление альдегидов гидроксидом меди (II) также является качественной реакцией на альдегидную группу. Cu+2 из гидроксида меди голубого цвета восстанавливается до Cu+1 в виде красного осадка Cu2O или даже до Cu0 красной металлической меди. В ЕГЭ принято писать реакцию с образованием Cu2O:
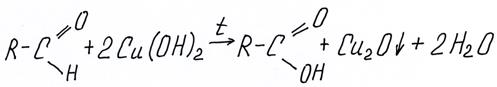
см. видео
https://youtu.be/ufePxUsSoqE
Окисление альдегидов растворами KMnO4 и K2Cr2O7
При написании этих реакций следует учитывать среду раствора – в кислой среде из альдегида образуется соответствующая кислота (из формальдегида – CO2),
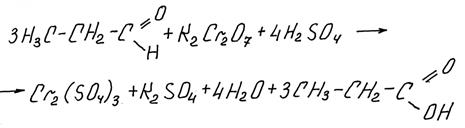
в нейтральной и щелочной среде – соли этой кислоты (из формальдегида – карбонаты). Здесь подробно рассмотрим, как составить реакцию формальдегида и KMnO4 в нейтральной среде.
Раньше, до ЕГЭ, нормально было бы записать
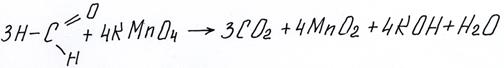
В ЕГЭ же четко отслеживается понимание обучающегося, что кислотный оксид и щелочь дадут соль, причем в этих соотношениях, смесь солей:
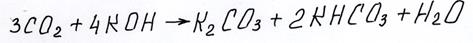
таким образом, окисление формальдегида должно быть написано так:
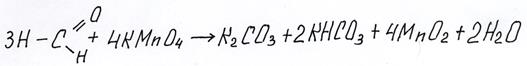
Посмотрите видео
https://youtu.be/gBPSdMZFspI
и запишите представленные в нем реакции.
Также нужно помнить, что альдегиды окисляются кислородом, оксидом меди сгорают на воздухе.
III Реакции конденсации
Альдегиды и кетоны содержат полярную двойную связь С=О, при раскрытии этой связи их молекулы могут объединятся, происходит так называемая конденсация.
Конденсацией называется реакция соединения двух или более простых молекул образуется в более сложную молекулу. Обычно в результате реакции конденсации выделяется молекула воды НГ и т.п.
1) Альдольная конденсация – химическая реакция между двумя молекулами альдегида (или кетона) с образованием т.н. альдоля – альдегидоспирта (или кетоноспирта). Реакция идет в присутствии кислоты или щелочи
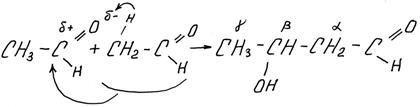
альдоль
3-гидроксибутаналь(IUPAC)
β-оксимасляный альдегид
По сути, это реакция присоединения по двойной связи. Понятно, что группа ОН окажется у второго атома углерода, не считая углерода в функциональной альдегидной группе. Это так называемый b-углерод. В рациональной номенклатуре часто для обозначения углерода используют не цифры, а греческие буквы, причем углерод функциональной группы не считают, первый от нее углерод называется a-, а последний – w-.
Альдоли можно получить, проводя реакцию на холоду, если же смесь нагреть, альдоль дегидратируется и образуется непредельный альдегид – это кротоновая конденсация:
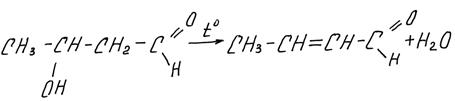
2) Конденсация с фенолом – образование фенол-формальдегидной смолы. Часто в тестовых заданиях среди веществ, с которыми могут реагировать альдегиды, указывается фенол. Реакцию поликонденсации между фенолом и формальдегидом (вряд ли ее придется писать на ЕГЭ) можно посмотреть во многих учебниках и интернет-рессурсах, приведу текст из
https://himija-online.ru/organicheskaya-ximiya/aldegidy-i-ketony/ximicheskie-svojstva-aldegidov-i-ketonov.html
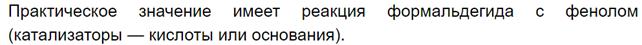

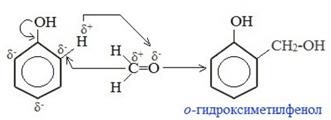


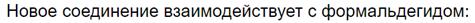
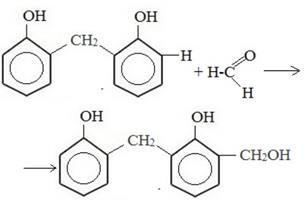

Очень наглядно поликонденсация показана на видео
https://youtu.be/HPcx0SbRHEw
Кетоны
Кетоны – это соединения вида
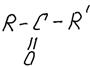
Кетоны изомерны альдегидам, у них одна общая формула:
С n H2 n O
Важнейшим представителем является ацетон, популярный растворитель
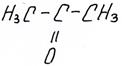 пропанон, ацетон, диметилкетон
пропанон, ацетон, диметилкетон
второй представитель гомологического ряда кетонов – бутанон:
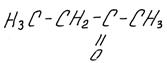 бутанон, метилэтилкетон
бутанон, метилэтилкетон
Как было указано выше, связь С=О менее полярна, чем в альдегидах, поэтому кетоны существенно менее реакционноспособны, чем альдегиды. Приведем химические свойства кетонов в той же последовательности, что и альдегидов.
I Реакции присоединения по связи С=О
1) Реакции гидрирования (гидрогенизации). Кетоны, как и альдегиды, достаточно легко восстанавливаются водородом до вторичных спиртов (альдегиды – до первичных):
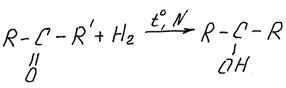
например
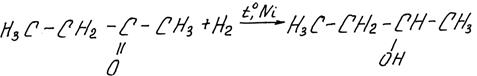
2) Не взаимодействуют со спиртами. В отличие от альдегидов, кетоны с большим трудом образуют кетали (соединения, подобные ацеталям). В ЕГЭ считается, что кетоны не реагируют со спиртами.
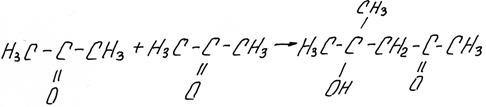
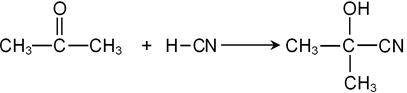
3) Присоединение HCN – кетоны, как и альдегиды, способны присоединять циановодород:
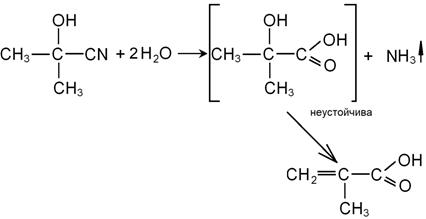
При гидролизе таких нитрилов образуются непредельные карбоновые кислоты:
II Окисление кетонов
Кетоны не окисляются, как альдегиды: не вступают в реакцию серебряного зеркала, не окисляются гидроксидом меди и в обычных условиях не реагируют с KMnO4 и K2Cr2O7. Только в очень жестких условиях их можно окислить с разрывом связей С–С, и, конечно, кетоны горят.
III Реакции конденсации
Кетоны под действием щелочей подвергаются альдольной самоконденсации, например ацетон образует диацетоновый спирт: