Химические свойства
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
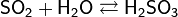
Со щелочами образует сульфиты:

Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:



Последняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидо углерода(II):

Или для получения фосфорноватистой кислоты:

Применение
Большая часть оксида серы (IV) используется для производства серной кислоты. Используется также в слабоалкогольных напитках (вина средней ценовой категории) в качестве консерванта (пищевая добавка E220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы (IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. При таковом его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и как следствие присутствия воды H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре. Оксид серы (IV) применяется также для получения различных солей сернистой кислоты.
Окси́д се́ры (VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
|
|
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3. Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
|
|
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или NaVO3):

Можно получить термическим разложением сульфатов:

или взаимодействием SO2 с озоном:

Для окисления SO2 используют также NO2:

Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:

Однако в данной реакции серная кислота образуется в виде аэрозоли, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:

и оксидами:

SO3 растворяется в 100%-й серной кислоте, образуя олеум:

2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:



3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:

Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:

Применение
Серный ангидрид используют в основном в производстве серной кислоты.
Производство серной кислоты
Сырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций, сульфаты железа, кальция и др.
|
|
Основные этапы
Основные стадии получения серной кислоты:
1. Обжиг сырья с получением SO2
2. Окисление SO2 в SO3
3. Абсорбция SO3
В промышленности применяют два метода окисления SO2 в производстве серной кислоты: контактный — с использованием твердых катализаторов (контактов), и нитрозный (башенный) — с оксидами азота. Контактный способ вытесняет нитрозный.
Ниже приведены реакции по производству серной кислоты из минерала пирита на катализаторе — оксиде ванадия (V).
1. 4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2. 2SO2 + O2 (V2O5) → 2SO3
3. SO3 + H2O → H2SO4
Известно сотни веществ, ускоряющих окисление SO2 до SO3, три лучших из них в порядке уменьшения активности: платина, пятиокись ванадия и окись железа. При этом платина отличается дороговизной и легко отравляется примесями, содержащимися в газе SO2, особенно мышьяком. Окись железа требует высоких температур для проявления каталитической активности (выше 625 гр. C). Таким образом, ванадиевый катализатор является наиболее рациональным, и только он применяется при производстве серной кислоты.
Нитрозный метод получения серной кислоты
1. SO2+ NO2→ SO3 + NO↑.
2. 2NO+O2 → 2NO2
При реакции SO3 с водой выделяется огромное количество теплоты, и серная кислота начинает закипать с образованием "туманов" SO3 + H2O = H2SO4 + Q. Поэтому SO3 смешивается с H2SO4, образуя раствор SO3 в 91% H2SO4 - олеум
Получение серной кислоты (т.н. купоросное масло) из железного купороса - термическое разложение сульфата железа (II) с последующим охлаждением смеси
1. 2FeSO4·7H2O→Fe2O3+SO2+H2O+O2
2. SO2+H2O+O2 ⇆ H2SO4
Оксид углерода (II)
Одним из наиболее токсичных веществ, загрязняющих атмосферу, является окид углерода СО, который активно взаимодействует с гемоглобином крови и уже при очень низкой концентрации снижает ее способность переносить кислород. Содержание СО в воздухе около 0,01 % (по объему) вызывает головную боль. снижение умственной деятельности и расстройство ряда физиологических функций организма.Основную массу глобальных выбросов СО дают двигатели внутреннего Джек ричер смотреть наwww.джекричер-онлайн.рф.
Соединие серы
Соедннеиня серы.Сера — биогенный элемент, необходимый для живых организмов, и обязательный элемент питания растений.В зоне гипергенеза сера проявляет все известные для нее степени окисления: — 2, + 4, + 6, из них наиболее характерны — 2 и + 6. Это обусловливает существенную роль окислительно-восстановительных реакций и разнообразие процессов миграции (А.И. Перельман, 1966). Восстановленные формы серы (S*, H2S, сульфиды) легко окисляются до сульфатов
Углеводороды
К числу глобальных загрязнений биосферы следует отнести ее загрязнение углеводородами, 95 % выбросов которых также приходится на северное Полушарие.Почти не представляя опасности как самостоятельные загрязняющие вещества воздушной среды (за исключением высоких концентраций — до 10 частей на миллион и более), углеводороды обусловливают мощность и плотность фотохимического смога. При этом в результате фотохимических реакций углеводороды Обзоры и отзывы - новая Евразия - зайдите на наш сайт.
В настоящее время значительным источником серы стали техногенные выбросы предприятий металлургической, нефтяной и других отраслей промышленности.
Диоксид серы SO, составляет более 95 % всех техногенных выбросов серосодержащих веществ в атмосферу. По ряду данных, планетарный выброс SO, составляет около 110,4 млн т (без учета нефтепереработки и выплавки металлов). С учетом этих отраслей экономики американские ученые считают мировой выброс SO, равным 147 млн т. Около 96 % мирового выброса SO, приходится на северное полушарие. Сравнительно большая доля стран Восточной и Западной Европы по этим вилам загрязнения атмосферы объясняется высоким уровнем использования бурого угля в энергопроизводстве. Есть основания полагать, что ежегодные выбросы SO, в атмосферу будут возрастать в связи с ростом потребления топлива. По оценке экспертов Массачусетского технологического института (США), в 2000 г. мировой выброс SO2, в атмосферу достиг 275 млн т и стал соизмерим с природными поступлениями соединений серы в воздушную среду.
Присутствие оксидов серы в атмосфере оказывает негативное влияние на жизнедеятельность животных и растений: диоксид серы взаимодействует с кислородом воздуха с образованием SO, и в конечном счете H2S04:
2S02 + 02-»2SO,
S03+H20-»H2S04
Анализ данных о круговороте серы в окружающей среде показывает, что выброс техногенного диоксида серы составляет 30 % от его общего поступления в атмосферу. Ежегодный прирост содержания серы в форме SOJ" на суше составляет около 1,54 • 10" моль/год (без учета поступления техногенного SOJ из отходов переработки сульфидных руд). Прирост содержания серы в океане (за счет SO:) оценивается как 1 • 10" моль/год, что составляет менее 3 • 10"6% общего количества серы в воде. Сера в почвах представлена органическими и неорганическими соединениями, соотношение которых зависит от типа почвы и от глубины залегания генетического горизонта. Наиболее доступная растениям сульфатная форма составляет не более 10—25 % от общего содержания серы. Основные поступления серы в по ту происходят с пылью и «кислыми дождями», причем с пылевой фракцией серы поступает в десятки раз больше, чем с «кислыми дождями» (по М.А. Глазовской, В.П. Учватову, 1981).
Часть серы, поступившей в почву из атмосферы, закрепляется в подстилке, часть мигрирует вниз по профилю. В среднем количество поглощенной подстилкой серы может составлять до одной трети от количества элемента, поступившего с атмосферными осадками (А.В. Костенко, 1975).
Выбросы сернистого газа в биосферу, а также последующее под-кисление водоемов, почвенного и растительного покрова оказывает существенное воздействие на живые организмы, которое проявляется во влиянии на земные экосистемы (например, ожоги листьев, поражение хвои) и на здоровье человека. Косвенное воздействие выражается, например, в поражении наземной растительности вследствие изменения метаболических процессов в почве и соответствующего изменения характера питания растений, в гибели гидробионтов в результате образования токсических соединений (алюминия, тяжелых металлов) при снижении рН.
Миграция и трансформация серы имеют большое значение в биогеохимии почв. Почвы с дефицитом серы обычно встречаются на территориях, удаленных от антропогенных источников серы. В развитых промышленных районах Северной Америки и Европы, особенно при использовании в качестве топлива сернистых углей, атмосферный привнос серы значителен в результате эмиссии диоксида S02. Быстрый переход его в серную кислоту H,SO, оказывается причиной кислотных выпадений. Однако повышенная кислотность атмосферных выпадений связана не только с эмиссией газообразных оксидов серы, но и с миграцией сульфатов — основной формы серы в почвенном растворе. Они, в свою очередь, оказывают влияние на круговорот металлов — элементов питания (Са, Na, К), а также токсичного для растений алюминия.
Любопытной чертой круговорота серы считают ее способность переходить в неорганические соединения, особенно в тех случаях, когда она находится в избытке. Мы знаем о довольно высокой концентрации SO 4 в растительных тканях, нередко превышающей половину общего количества серы, преимущественно в районах существенного атмосферного привноса. Мы не знаем точно, какова роль неорганической серы в питании растений, однако для нас очевидна роль so2 как необходимого компонента цикла серы.
Тематический материал