РАСЧЕТЫМАССЫВЕЩЕСТВА ИЛИ ОБЪЕМА ГАЗОВ ПО ИЗВЕСТНОМУ КОЛИЧЕСТВУ ВЕЩЕСТВА, МАССЕ ИЛИ ОБЪЕМУ ОДНОГО ИЗ УЧАСТВУЮЩИХ В РЕАКЦИИ ВЕЩЕСТВ
Основой для проведения количественных расчетов в химии является закон сохранения масс.
Согласно этому закону, масса реагентов равна массе продуктов реакции.
Вещества, которые вступили в реакцию, называются реагентами, а получившиеся — продуктами.
При написании уравнений химических реакций надо следить за соблюдением этого закона. Число атомов элемента в левой и правой частях реакций должно быть одинаковым, так как атомные частицы в химических превращениях неделимы и никуда не исчезают, а лишь переходят из одного вещества в другое. Сущность химической реакции – разрыв одних связей и образование других связей.
Для решения расчетных задач по химическим уравнениям можно использовать два способа: через пропорцию или через количество вещества.
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значения величин: молярные массы, массы, количества веществ или их объемы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.

Повторение ранее изученного материала
Атом – частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Количество вещества – это порция данного вещества, содержащая определенное число его структурных единиц. Химическое количество вещества обозначают латинской буквой n. В российских и советских источниках часто встречается обозначение ν. Это одна из семи основных физических величин Международной системы единиц (СИ).
Стехиометрические коэффициенты – Это значение, которые стоят перед формулой определенного вещества в химическом уравнении, этот коэффициент отражает количество веществ, которые участвуют в конкретной химической реакции.
Алгоритм решения задач по уравнению химической реакции
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ | |||
| 1. НА НАХОЖДЕНИЕ МАССЫВЕЩЕСТВА | ||||
| 1.1 метод пропорций | ||||
| 1.Прочитайте текст задачи. | Какая масса гидроксида натрия необходима для реакции с 68,6 г ортофосфорной кислоты с образованием средней соли? | |||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. |  2.Дано:
m (H3PO4) = 68,6 г 2.Дано:
m (H3PO4) = 68,6 г
m (NaOH) =?
| |||
| 3. Запишите уравнение реакции | 3.Решение: 3NaOH + H3PO4 = Na3PO4 + 3H2O | |||
| 4. Над формулами записать, что известно по условию задачи | Х г 68,6 г 3NaOH + H3PO4 = Na3PO4 + 3H2O | |||
| 5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массы гидроксида натрия и ортофосфорной кислоты). (ν – коэффициенты перед соответствующими веществами) | Mr (NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40 M (NaOH) = 40 г/моль m (NaOH) = ν · M = 3 моль · 40 г/моль = 120 г Mr (H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 · 1 + 31 + 4 · 16 = 98 M (H3PO4) = 98 г/моль m (H3PO4) = ν · M = 1 моль · 98 г/моль = 98 г Х г 68,6 г 3NaOH + H3PO4 = Na3PO4 + 3H2O 120 г 98 г | |||
| 6. Составляем пропорцию и производим расчёт | 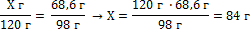
| |||
| 1.2 Количественный метод | ||||
| 1.Прочитайте текст задачи. | Какая масса гидроксида натрия необходима для реакции с 68,6 г ортофосфорной кислоты с образованием средней соли? | |||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. |  2.Дано:
m (H3PO4) = 68,6 г 2.Дано:
m (H3PO4) = 68,6 г
m (NaOH) =?
| |||
| 3. Запишите уравнение реакции | 3.Решение: 3NaOH + H3PO4 = Na3PO4 + 3H2O | |||
| 4. Рассчитать молярные массы гидроксида натрия и ортофосфорной кислоты | Mr (NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40 M (NaOH) = 40 г/моль Mr (H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 · 1 + 31 + 4 · 16 = 98 M (H3PO4) = 98 г/моль | |||
| 5. Рассчитать количество ортофосфорной кислоты по формуле | 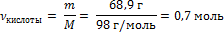
| |||
| 6. Записать в уравнении данные по условию уравнения и полученные величины над формулами, под формулам - количество данных веществ (ν – коэффициенты перед соответствующими веществами) | Х моль 0,7 моль 3NaOH + H3PO4 = Na3PO4 + 3H2O 3 моль 1 моль | |||
| 7. Составить и решить пропорцию | 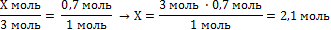
| |||
| 8. По формуле найти массу гидроксида натрия | m (NaOH) = ν · M = 2,1 моль · 40 г/моль = 84 г | |||
| 9. Записать ответ | Ответ: m (NaOH) = 84 г | |||
| 2. НА НАХОЖДЕНИЕ ОБЪЕМА ВЕЩЕСТВА | ||||
| 2.1 Метод пропорций | ||||
| 1.Прочитайте текст задачи. | Какой объём газа выделится при взаимодействии 6,5 г цинка с избытком раствора серной кислоты? | |||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. |  2.Дано:
m (Zn) = 6,5 г 2.Дано:
m (Zn) = 6,5 г
  V(Н2) =?
V(Н2) =?
| |||
| 3. Запишите уравнение реакции | 3.Решение: Zn + H2SO4 = ZnSO4 + H2↑ | |||
| 4. Над формулами записать, что известно по условию задачи | 6,5 г Х л Zn + H2SO4 = ZnSO4 + H2↑ | |||
| 5. Вычислить массу цинка и объём водорода по уравнению реакции | Mr (Zn) = Ar(Zn) = 65 M (Zn) = 65 г/моль m (Zn) = ν · M = 1 моль · 65 г/моль = 65 г V = ν · Vm = 1 моль · 22,4 л/моль = 22,4 л | |||
| 6. Полученные величины записать под соответствующими формулами | 6,5 г Х л Zn + H2SO4 = ZnSO4 + H2↑ 65 г 22,4 л | |||
| 7. Составить и решить пропорцию | 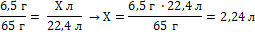
| |||
| 2.2 Количественный метод | ||||
| выполнить 1 – 3 | ||||
| 4. Рассчитать количество цинка | Mr (Zn) = Ar(Zn) = 65
M (Zn) = 65 г/моль
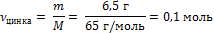
| |||
| 5. Полученную величину записать в уравнение над формулой цинка, под формулами количество вещества по уравнению реакции (коэффициенты перед формулами) | 0,1 моль Х моль Zn + H2SO4 = ZnSO4 + H2↑ 1 моль 1 моль | |||
| 6. Составить пропорцию и решить | 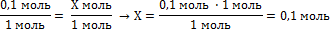
| |||
| 7. По формуле найти объём выделившегося газа | Vm = 22,4 л/моль V = ν · Vm V(H2) = 0,1 моль · 22,4 л/моль = 2,24 л | |||
| Записать ответ | Отсвет: V(H2) = 2,24 л | |||
| 3. НА НАХОЖДЕНИЕ КОЛИЧЕСТВА ВЕЩЕСТВА | ||||
| 3.1 Метод пропорций | ||||
| 1.Прочитайте текст задачи. | Какое количество вещества алюминия реагировало с избытком соляной кислоты, если в ходе реакции выделилось 13,44 л (н.у.) водорода? | |||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. |  2.Дано:
V (Н2) = 13,44 л
н.у. 2.Дано:
V (Н2) = 13,44 л
н.у.
  ν (Al) =?
ν (Al) =?
| |||
| 3. Запишите уравнение реакции | 3 Решение: Al + HCl = AlCl3 + H2↑ | |||
| 4. Над формулами записать, что известно по условию задачи | Х моль 13,44 л 2Al + 6HCl = 2AlCl3 + 3H2↑ | |||
| 5. По формуле вычислите объём водорода (по уравнению реакции) | V = ν · Vm V(H2) = 3 моль · 22,4 л/моль = 67,2 л | |||
| 6. Под формулами записать рассчитанный объём водорода и количество алюминия по уравнению реакции (коэффициент перед формулой) | Х моль 13,44 л 2Al + 6HCl = 2AlCl3 + 3H2↑ 2 моль 67,2 л | |||
| 7. Составить пропорцию и решить | 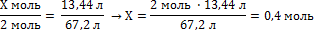
| |||
| 3.2 Количественный метод | ||||
| выполнить пункты 1 - 3 | ||||
| 4. Рассчитать количество водорода | 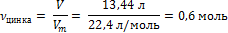
| |||
| 5. Над формулами записать, что известно и что надо найти | Х моль 0,6 моль 2Al + 6HCl = 2AlCl3 + 3H2↑ | |||
| 6. Под формулами записать количество водорода и количество алюминия по уравнению реакции (коэффициент перед формулой) | Х моль 0,6 моль 2Al + 6HCl = 2AlCl3 + 3H2↑ 2 моль 3 моль | |||
| 7. Составить пропорцию и решить | 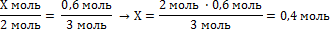
| |||
| Записать ответ | Ответ: ν (Al) = 0,4 моль |
