МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТУЛЬСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Т.И. Субботина, В.Н. Морозов, Е.И. Савин
Патологическая физиология крови
Учебное пособие
Тула
Издательство ТулГУ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТУЛЬСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Т.И.Субботина, В.Н. Морозов, Е.И.Савин
Патологическая физиология крови
Учебное пособие
Тула
Издательство ТулГУ
УДК 681.51:621.391.008.05
Субботина Т.И., Морозов В.Н., Савин Е.И. Патологическая физиология крови: учеб.пособие, Тула: изд-во ТулГУ, 2011. 110с.
Настоящее учебное пособие предназначено для изучения патологической физиологии крови студентами медицинских и биологических специальностей. Содержит теоретический учебный материал, а также примеры разбора конкретных анализов. Пособие предназначено для самостоятельной работы и проведения аудиторных практических занятий по курсу патофизиологии. Составлено на основе примерной программы по патофизиологии для специальности «060101» – Лечебное дело.
Печатается по решению библиотечно-издательского совета Тульского государственного университета
Рецензенты:
Д-р.мед.наук, профессор, заведующий кафедрой хирургических болезней №1 ТулГУ А.З. Гусейнов,
Канд.мед.наук, доц. кафедры фармакологии ТулГУ С.С. Леонтьев
ISBN 978-5-7679-1849-2
ВВЕДЕНИЕ
Кровь представляет собой одну из важнейших систем жизнеобеспечения организма, обладающую рядом особенностей. Высокая митотическая активность гемопоэтической ткани обусловливает ее высокую чувствительность к действию повреждающих факторов, а генетическая детерминированность размножения, дифференцировки, структуры и обмена веществ кровяных клеток создают предпосылки как для геномных нарушений, так и для изменений генетической регуляции.
Своеобразие системы крови выражается и в том, что ее патологические изменения возникают не только от нарушений функций отдельных ее компонентов, но и от нарушений функций других органов и систем организма. Любое заболевание, патологический процесс, а так же ряд физиологических сдвигов могут в той или иной степени отразиться на количественных или качественных особенностях состава циркулирующей крови. Этим определяется огромное значение изучения крови как "кровяного зеркала организма" и вскрытия закономерностей ее изменения при различных заболеваниях.
В методических рекомендациях содержатся сведения о различных патологических процессах, состояниях и заболеваниях системы крови, представлены алгоритмы и примеры разборов анализов крови, приведены показатели общего и биохимического анализов крови,а также показатели гемостазиограммы в норме.
Данное пособие предназначено для студентов специальности 060101 «Лечебное дело», а также для интернов, ординаторов, практикующих врачей и аспирантов.
РАЗДЕЛ I
Кроветворение
Стволовые кроветворные клетки и клетки-предшественники
Стволовые кроветворные клетки – это самообновляющаяся популяция клеток, из которых в процессе деления и дифференцировки образуются клетки – предшественники основных ростков кроветворения: эритроидного, гранулоцитарно-моноцитарного, мегакарциоцитарного и лимфоидного. Ранние клетки-предшественники характеризуются полипотентностью, более поздние способны дифференцироваться в направлении одного, двух или трех ростков кроветворения. Морфологически стволовые кроветворные клетки и клетки-предшественники напоминают малые и средние лимфоциты.
Ретикулярная строма костного мозга образует микроокружение, необходимое для пролиферации и дифференцировки стволовых кроветворных клеток(см. 1.1). Кроветворение можно воссоздать in vitro – в смешанной культуре костного мозга, содержащей как кроветворные, так и стромальные клетки. У эмбриона кроветворение происходит в желточном мешке, у плода – в печени и селезенке. Клетки-предшественники морфологически неотличимы от других лимфоцитоподобных клеток, однако в культуре костного мозга их можно идентифицировать. Стволовые кроветворные клетки человека плохо поддаются культивированию in vitro, но образуют селезеночные колонии при введении облученным мышам. Разработано множество сред для культивирования более поздних, унипотентных клеток-предшественников. В культуральной среде клетки-предшественники выделяются тем, что выполняют функцию колониеобразующих единиц. Самая ранняя клетка-предшественник, дающая начало гранулоцитам, эритроцитам, моноцитам и мегакариоцитам, получила название гранулоцитарно-эритроцитарно-моноцитарно-мегакариоцитарной колониеобразующей единицы. К более зрелым и дифференцированным клеткам-предшественникам относятся гранулоцитарно-моноцитарная, эозинофильная, базофильная, эритроцитарная и мегакариоцитарная колониеобразующие единицы. Среди клеток-предшественников эритроидного ростка выделяют также бурстобразующую единицу; это более ранняя клетка по сравнению с колониеобразующей единицей. В настоящее время считается, что кроветворные и мезенхимные стволовые клетки происходят от общей стволовой клетки.
МОЛЕКУЛЫАДГЕЗИИ
Прикрепление клеток друг к другу и к внеклеточному матриксу обеспечивают молекулы адгезии. Расположенные на лейкоцитах и кроветворных клетках молекулы адгезии называются рецепторами; они связываются с лигандами – специфическими молекулами на поверхности клеток-мишеней. В зависимости от химической структуры молекулы адгезии делят на шесть групп: три большие – суперсемейство иммуноглобулинов, селектины и интегрины – и три малые, недавно открытые, группы – кадгерины, синдеканы и молекулы адгезии ADAM (A Disintegrin And Metalloprotease).
Селектины обеспечивают прикрепление циркулирующих лейкоцитов к стенке сосуда. Лигандом для селектинов служит сиалированный углеводород на поверхности клетки-мишени. L-селектин имеется почти на всех лейкоцитах крови; P-селектин запасается в эндотелиальных клетках в виде гранул Вейбеля – Паладе.
Интегрины обеспечивают адгезию гранулоцитов к стенке сосуда в процессе миграции и передачу сигналов, стимулирующих пролиферацию и дифференцировку клеток. Они играют роль связующего звена между внеклеточным матриксом и цитоскелетом и участвуют во взаимодействии клеток между собой и с внеклеточным матриксом (например, с коллагеном, фибронектином, фактором фон Виллебранда). Интегрины состоят из α- и β-субединиц; известны восемь разных β-субъединиц и более двадцати комбинаций α и β-субъединиц. Интегрины участвуют в передаче сигналов как извне к клеточному ядру (например, связываясь с внеклеточным матриксом, они могут изменять экспрессию гена), так и в обратном направлении (примером может служить мобилизация лейкоцитов при воспалении). Дефицит β2-субъединицы проявляется синдромом недостаточной адгезии лейкоцитов типа 1; когда доля лимфоцитов CD8 составляет 0-1%, заболевание протекает в тяжелой форме, когда 2-5% - в среднетяжелой. Дефицит αIIбβ3 –интегрина вызывает тромбастению Гланцмана.
РОСТОВЫЕ КРОВЕТВОРНЫЕ ФАКТОРЫ
Пролиферация стволовых клеток и клеток-предшественников регулируется биологически активными веществами – индукторами роста и дифференцировки, способными действовать локально или через системный кровоток. Эти вещества синтезируются клетками стромы и самими кроветворными клетками (колониестимулирующие факторы, интерлейкины), почками (эритропоэтин),печенью (тромбопоэтин).
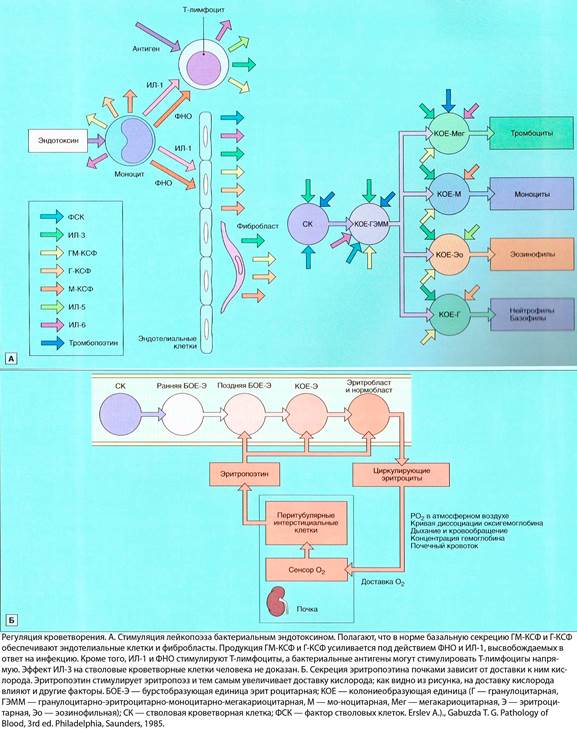
Ростовые кроветворные факторы представляют собой гликопротеиды. Они обеспечивают самообновление стволовых клеток и пролиферацию и дифференцировку коммитированных клеток-предшественников(см. 1.2), регулируют функции дифференцированных клеток, а также увеличивают продукцию лейкоцитов при инфекции, эритроцитов при анемии и тромбоцитов при тромбоцитопении. Те из них, которые стимулируют образование клетками-предшественниками колоний in vitro, называются колониестимулирущими факторами. Название каждого колониестимулирующего фактора начинается с названия колонии, которая образуется под его действием(например, гранулоцитарный колониестимулирующий фактор, или Г-КСФ, стимулирует рост колоний гранулоцитов), хотя и известно, что эти факторы во многом дублируют эффекты друг друга(см. 1.3).
Фактор стволовых клеток стимулирует пролиферацию и дифференцировку стволовых кроветворных клеток и синергично с другими ростовыми факторами действует как на созревающие, так и на зрелые клетки. Цитокин FL тоже действует на стволовые клетки и клетки-предшественники. ИЛ-6 синергично с другими факторами действует на ранние клетки-предшественники; возможно, он участвует и в мегакариоцитопоэзе. Препараты Г-КСФ, ГМ-КСФ и М-КСФ применяют для стимуляции лейкопоэза при химиотерапии, трансплантации костного мозга, лечении СПИДа, миелодиспластических синдромов и апластической анемии, а также при идиопатических и лекарственных нейтропении и агранулоцитозе. Кроме того, препараты колониестимулирующих факторов используют перед аутотрансплантацией костного мозга, чтобы активизировать выход стволовых клеток их костного мозга и заготовить их как можно больше.
ИЛ-3(ранее известный как полипотентный колониестимулирующий фактор) и ГМ-КСФ в процессе кроветворения требуются постоянно, так как они действуют не на строго определенный росток кроветворения, а на полипотентные клетки и ранние клетки-предшественники, опосредуя их самообновление и дифференцировку. Г-КСФ, М-КСФ, ИЛ-5, тромбопоэтин и эритропоэтин влияют на более зрелые клетки отдельных ростков, но при этом действуют и на ранние клетки-предшественники, синергично с другими ростовыми факторами. Источниками колониестимулирующих факторов служат стромальные клетки костного мозга (фибробласты и эндотелиальные клетки), лимфоциты и макрофаги. Выделяемые моноцитами ИЛ-1 и ФНО, по-видимому, стимулируют секрецию Г-КСФ и ГМ-КСФ фиксированными клетками стромы, а также макрофагами и Т-лимфоцитами. Все эти клетки способны синтезировать также Г-КСФ, М-КСФ и эозинофильные колониестимулирующие факторы. ИЛ-8 является хемоаттрактантом для нейтрофилов и Т-лимфоцитов; кроме того, он играет важнкую роль в миграции нейтрофилов.
ЭРИТРОПОЭТИН
Эритропоэтин (молекулярная масса после полного гликозилирования 34000-39000, до гликозилирования 18400) вырабатывается почками и, в небольших количествах, печенью в ответ на гипоксию, вызванную анемией, пребыванием на большой высоте или другими причинами. Эритропоэтин стимулирует эритропоэз, действуя главным образом на стадии коммитированного предшественника – эритроцитарной колониеобразующей единицы. Кроме того, к нему чувсвительны часть эритроцитарных бурстобразующих единиц и созревающие клетки (вплоть до ретикулоцита).Клетки-предшественники эритропоэтин побуждает к пролиферации и дифференцировке, а созревающие клетки – к синтезу гемоглобина.
ТРОМБОПОЭТИН
В процессе трансляции гена тромбопоэтина образуется полипептид из 353 аминокислот, включающий сигнальный пептид из 21 аминокислоты. Зрелый тромбопоэтин состоит из 332 аминокислот и имеет молекулярную массу 38000. Его N-концевой участок (155 аминокислот) на 46% гомологичен эритропоэтину и на 21% идентичен ему. С-концевой участок тромбопоэтина (177 аминокислот) содержит многочисленные углеводные остатки у атомов азота и кислорода. Тромбопоэтин синтезируется в печени и, в небольшом количестве, в почках. Он обеспечивает самообновление и пролиферацию стволовых кроветворных клеток и мегакариоцитарных колониеобразующих единиц, стимулирует образование мегакариоцитов, воздействуя в том числе на такие процессы, как эндомитоз и возникновение полиплоидии, а также ускоряет созревание тромбоцитов, экспрессию ими маркеров СD41 и CD61 и выход тромбоцитов в кровь. При ежедневном введении человеку тромбопоэтина число тромбоцитов увеличивается спустя 7-10 сут.; после отмены препарата оно остается повышенным в течение 6-16 сут. Т1/2 тромбопоэтина составляет 30 часов, что превышает Т1/2 всех остальных ростовых кроветворных факторов. Вместе с эритропоэтином тромбопоэтин стимулирует пролиферацию клеток – предшественников эритроидного ростка.
ЦИТОКИНЫ
Цитокины– это гликопротеиды, выделяемые лимфоцитами и моноцитами (макрофагами) и оказывающие широкий спектр эффектов на кроветворение, иммунные реакции, ответ организма на инфекцию и опухолевую инвазию.
ИНТЕРЛЕЙКИН-1
Источником ИЛ-1 служат активированные макрофаги, а также эндотелиальные клетки, астроциты, фибробласты и Т-лимфоциты. ИЛ-1 секретируется в двух формах – ИЛ-1α и ИЛ-1β- в соотношении 1:10. Обе формы биологически активны и вызывают миграцию и активацию клеток, участвующих в воспалительной реакции, заживлении ран, иммунном ответе и ранних стадиях кроветворения. Этот цитокин:
-является эндогенным пирогеном;
-активирует лимфоциты, в том числе NK-лимфоциты, нейтрофилы и другие фагоциты;
-стимулирует пролиферацию остеокластов, фибробластов, эпителиальных, эндотелиальных и синовиальных клеток;
-усиливает экспрессию антигенов HLA класса II;
-усиливает синтез простагландинов и коллагеназы;
-увеличивает секрецию колониестимулирующих факторов стромальными клетками костного мозга, тем самым играя важную роль в кроветворении.
ИНТЕРЛЕЙКИН-2
ИЛ-2 усиливает пролиферацию Т-лимфоцитов, а также, хотя и в меньшей степени, В-лимфоцитов и моноцитов. ИЛ-2 повышает цитотоксическую активность NK-лимфоцитов, стимулируя их пролиферацию и функциональную активность. Рецептор ИЛ-2 состоит из трех полипептидных цепей, одна из которых выявляется с помощью моноклональных антител к CD25.
ИНТЕРЛЕЙКИН-4
ИЛ-4 оказывает множество разных эффектов как на кроветворение, так и на пролиферацию и дифференцировку В- и Т-лимфоцитов. Он необходим для переключения синтеза классов иммуноглобулинов в В-лимфоцитах.
ИНТЕРЛЕЙКИН-6
Подобно ИЛ-1, ИЛ-6 оказывает разнообразные эффекты на кроветворение и иммунную систему, а также играет роль белка острой фазы воспаления. Полагают, что он участвует в тромбоцитопоэзе, но не обязателен для этого процесса.
ИНТЕРЛЕЙКИНЫ7-15
Открытые позже цитокины - с ИЛ-7 по ИЛ-15 – участвуют в кроветворении и необходимы для пролиферации и функционирования клеток иммунной системы.
АПОПТОЗ
Гибель клетки может быть результатом некроза или физиологического процесса – апоптоза (запрограммированной гибели). Некроз возникает вследствие ишемии, химического воздействия, гипертермии. Обычно он затрагивает группы клеток и характеризуется набуханием клеток, ранней утратой целости клеточных мембран, разрушением органелл и сморщиванием ядра.
Как правило, при некрозе образуется воспалительный инфильтрат из фагоцитов вследствие выделения содержимого клеток в окружающее пространство. Апоптоз – это активный процесс, для которого необходимы ионы кальция. Вначале наблюдаются конденсация хроматина, распад ядра на фрагменты (кариорексис) и вакуолизация цитоплазмы, затем – изменения органелл и клеточной мембраны. Во время апоптоза происходит фрагментация ДНК за счет расщепления эндонуклеазой обеих цепей в промежутках между нуклеосомами, и при гель-электрофорезе появляется характерная «лестница» ДНК с правильным шагом в 180 пар нуклеотидов. В заключительном этапе апоптоза участвует семейство протеаз под названием каспазы. Каспаза-3 расщепляет некоторые клеточные белки, в том числе поли-(АДФ-рибозо)-полимеразу, ламинин и гельзолин. Каспаза-3 активируется каспазой-9. Последнюю активирует белок АPАF-1(фактор 1), активирующий апоптозную протеазу) под действием цитохрома с. Цитохром с высвобождается из митохондрий, когда ускоряющий апоптоз белок Вах накапливается в избытке и образует гомодимеры. Защищает клетки от апоптоза белой Вс12, который связывается с белком Вах и таким образом подавляет высвобождение цитохрома с и активацию каспаз. Ускоряет апоптоз белок Ваd, образующий гетеродимеры с Вс12.
Апоптоз могут запускать внеклеточные факторы, например ФНО и Fas-лиганд, активируя каскад клеточных протеаз, относящихся к семейству ИЛ-1-превращающего фермента. Рецепторы ФНО и Fas-лиганда (СD95, или белок Fas) сопряжены с каспазой-8. Олигомеризация рецепторов в ответ на связывание с ними лигандов напрямую ведет к активации этого фермента. Кроме того, апоптоз может быть вызван непосредственным повреждением ДНК (ионизирующим излучением или лекарственными средствами) и дефицитом факторов выживания клеток (например, ИЛ-3). Эти вещества способствуют выживанию клетки, стимулируя фосфорилирование белка Ваd протеинкиназой В и предотвращая тем самым его связывание с белком Вс12.
ИНТЕРФЕРОНЫ
Интерфероны – это белки, синтезируемые множеством разных клеток в ответ на вирусную инфекцию. Они подавляют репродукцию вируса, индуцируя синтез клеточных РНК и белков. Интерферон α имеет молекулярную массу 18000-20000 и представляет собой семейство белков, кодируемых разными генами. Биологические эффекты интерферона α одосредуются через активацию 2’,5’-олигоаденилатсинтетазы, протеинкиназы и других белков. Интерферон α вызывает разнообразные изменения в работе иммунной системы, усиливая цитотоксическую активность NK-лимфоцитов и других эффекторных клеток, подавляя пролиферацию лимфоцитов, блокируя апоптоз и изменяя экспрессию мембранных антигенов.
Интерферон γ продуцируется Т- лимфоцитами под действием ИЛ1 и ИЛ-2. Он активирует NK-лимфоциты и усиливает экспрессию антигенов HLA класса IIВ- и Т-лимфоцитами, антигенпредставляющими клетками, а также эндотелиальными, эпителиальными и другими клетками, не относящимися к иммунной системе. Интерферон γ стимулирует фагоцитарную функцию макрофагов и секрецию ими ИЛ-1. Кроме того, он оказывает мощное тормозное действие на клеточную пролиферацию и угнетает апоптоз В-лимфоцитов.
ФАКТОРЫНЕКРОЗА ОПУХОЛЕЙ
ФНОα (кахетин), белок с молекулярной массой 17000, продуцируется макрофагами и NK-лимфоцитами. Он вызывает лизис некоторых опухолевых клеток (и в меньшей степени – соответствующих нормальных клеток), паразитов, а также ранних клеток – предшественников кроветворения. Подобно ИЛ-1, ФНОα может действовать как медиатор воспаления, усиливая синтез коллагеназы и простагландинов и активируя нейтрофилы, эозинофилы и моноциты. Кроме того, ФНОα - это медиатор септического шока и кахексии. Вещество, близкое по структуре к ФНОα и продуцируемое лимфоцитами CD4 и CD8, получило название ФНОβ (лимфотоксин); его эффекты сходны с таковыми ФНОα.
ФАКТОР, УГНЕТАЮЩИЙ МИГРАЦИЮ МАКРОФАГОВ
Фактор, угнетающий миграцию макрофагов, выделяется Т-лимфоцитами и подавляет миграцию макрофагов, задерживая их в очаге воспаления и в опухолевой ткани. К родственным ему факторам относятся продуцируемые лимфоцитами факторы активации и хемотаксиса макрофагов.
ВЗАИМОДЕЙСТВИЕ ФАКТОРОВ РОСТА С КЛЕТКАМИ
Рецепторы факторов роста
Постепенно выясняется и механизм, посредством которого внешний сигнал, побуждающий клетку к пролиферации или дифференцировке, передается с мембраны на ядро. Факторы роста связываются со своими рецепторами на клеточной мембране и активируют их. Рецепторы цитокинов имеют одинаковую структуру: все они представляют собой трансмембранные гликопротеиды с N-концевым внеклеточным рецепторным доменом, коротким гидрофобным трансмембранным доменом и С-концевым внутриклеточным доменом. Однако принадлежат они к разным семействам. Большинство рецепторов интерлейкинов и ростовых кроветворных факторов относятся к цитокиновым рецепторам типов I и II. Для цитокиновых рецепторов типа I характерно наличие одного или двух консервативных доменов во внеклеточном участке. Каждый из них содержит два фибронектиновых повтора типа III: один с четырьмя равноудаленными остатками цистеина, другой с последовательностью из 5 аминокислотных остатков – триптофан-серин-X-триптофан-серин(WXSWS). Цитокиновые рецепторы типа II лишены последовательности WXSWS. Оба типа цитокиновых рецепторов содержат консервативный внутриклеточный домен – Вох 1, который важен для внутриклеточной передачи сигнала. Собственной ферментативной активностью они не обладают.
Суперсемейство иммуноглобулинов включает два класса рецепторов: с собственной тирозинкиназной активностью (например, рецепторы М- КСФ и фактора стволовых клеток) и с собственной серин- и треонинкиназной активностью (например, рецепторы трансформирующего фактора роста и ИЛ- 1). Запуск внутриклеточной передачи сигнала часто происходит посредством димеризации двух рецепторов после связывания с ними лиганда либо путем активации одной из цепей рецептора при связывании лиганда с гетеродимерным рецептором.
Внутриклеточная передача сигнала.
Связующим звеном между взаимодействием лиганда с рецептором и активацией факторов транскрипции, ведущей к изменению экспрессии регулирующих клеточный цикл генов, служит каскад реакций фосфорилирования. В некоторых рецепторах (например, рецепторах фактора стволовых клеток и М-КСФ) после связывания с лигандом происходит аутофосфорилирование тирозиновых остатков за счет тирозинкиназной активности внутриклеточного домена. Фосфотирозиновые остатки обеспечивают стыковку с рецептором внутриклеточных сигнальных молекул, содержащих SH2- домены (Scr Homolog 2), тем самым запуская цепь биохимических реакций. Основная роль в передаче сигнала в ядро и активации факторов транскрипции принадлежит белку Raf-1 и группе митоген – активируемых протеинкиназ ERK (киназ, регулируемых внеклеточными сигналами, - Extracellular Signal Regulated Kinases). Белки Ras активируются комплексом белков Grb2 и SOS. Еще один путь – активация фосфолипазы Cγ, катализирующей гидролиз мембранного липида фосфатидилинозитол- 4, 5- дифосфата с образованием двух вторых посредников: ДАГ и ИФ3. Фосфолипаза Cγ активируется при связывании с фосфотирозиновыми остатками рецептора. ДАГ активирует протеинкиназу С, которая фосфорилирует белки по сериновым и треониновым остаткам. ИФ3 высвобождает из внутриклеточных депо кальций. Механизм, посредством которого эти биохимические изменения приводят к передачи сигнала в ядро, неизвестен. При связывании с фосфотирозиновыми остатками рецептора активируется также фосфатидилинозитол-3-киназа. Этот формент фосфорилирует фосфатидилинозитолы в положении 3 инозотольного кольца, что приводит к активации протеинкиназы В, опосредующей пролиферацию и выживание клетки.
Передача сигнала от цитокиновых рецепторов, которые не обладают собственной ферментативной активностью, происходит через сопряженные с рецепторами тирозинкиназы JAK, или Янус-киназы, и факторы транскрипции STAT. В семейство Янус-киназ входят JAK1, JAK2, JAK3 и Туk2. Это цитоплазматические ферменты с молекулярной массой 130000, имеющие консервативный N-концевой участок, псевдокиназный домен и С-концевой домен с тирозинкиназной активностью. Янус-киназы активируются при связывании рецептора с лигандом и димеризации рецептора. В связывании и активации Янус-киназ участвуют консервативные внутриклеточные домены цитокинового рецептора BOX 1 и BOX 2. Активированные Янус-киназы фосфорилируют тирозиновые остатки в факторах транскрипции STAT (Signal Transducers and Activators of Transcription – передатчики сигнала и активаторы транскрипции). Факторы транскрипции STAT имеют молекулярную массу 80000-100000 и представляют собой ДНК-связывающие белки с С-концевым SH2-доменом и участком фосфорилирования. Активированные факторы транскрипции STAT образуют гомо- или гетеродимеры и перемещаются в ядро, где и взаимодействуют со специфическими последовательностями ДНК – промоторами чувсвительных к цитокинам генов. Помимо факторов транскрипции STAT Янус-киназы фосфорилируют и другие белки, в частности субстраты рецептора инсулина IRS-1 и IRS-2 и стыкующий белок Gab2. Образующиеся при этом фосфотирозиновые остатки обеспечивают стыковку с белками, содержащими SH2-домены, запуская тем самым цепь биохимических реакций, ведущую к активации группы митоген-активируемых протеинкиназ ERK.
Факторы транскрипции
Пути внутриклеточной передачи сигнала, запускаемые цитокинами, приводят к усилению экспрессии генов факторов транскрипции. Факторы транскрипции принадлежат к шести различным семействам. Экспрессия их генов усиливается за счет внутриядерного фосфорилирования (например, факторами транскрипции STAT или киназами ERK). ДНК-связывающий домен фактора транскрипции взаимодействует со специфической последовательностью ДНК – энхансером. Домен трансактивации обеспечивает связывание фактора транскрипции с компонентами транскрипционного аппарата (РНК-полимеразой и вспоиогательными белками) и облегчает взаимодействие транскрипционного аппарата с ТАТА-боксом промоторной области – последовательностью ДНК, которая служит сигналом начала транскрипции.
Клеточный цикл
Цитокины побуждают клетки к вступлению в митотический цикл. Циклины – это белки, концентрация которых колеблется на протяжении клеточного цикла из-за изменений скорости их синтеза и распада. Циклины активируют группу протеинкиназ – циклинзависимые киназы, или Cdk, - которые затем фосфорилируют различные белки. Белок Rb(продукт гена ретинобластомы RB1)после фосфорилирования утрачивает способность блокировать факторы транскрипции, в частности E2F, необходимые для перехода клетки из периода G1, в период S. Активность комплексов циклинов с циклинзависимыми киназами регулируется белками-ингибиторами. Так, комплексы циклина D c Cdk4 и Cdk6 подавляются белком с молекулярной массой 16000 – продуктом гена INK4А и белком с молекулярной массой 15000, который кодируется геном INK4B. Данные белки препятствуют переходу клетки в позднюю стадию G1.
Ген ТР53 кодирует белок р53 (молекулярная масса 53000), который останавливает клеточный цикл на стыке периодов G1 и S. Этот процесс опосредуется ингибитором циклинзависимых киназ – белком р21cip1. Сигналом к экспрессии ТР53 служит повреждение ДНК под действием ионизирующего излучения или лекарственных средств. В результате клетка задерживается в периоде G1 и получает возможность провести репарацию ДНК. При сильном повреждении белок р53 запускает апоптоз за счет усиления экспрессии белка Bax.
Протоонкогены и гены – супрессоры опухолевого роста
Изменение функции некоторых генов, в высшей степени консервативных у млекопитающих и других животных, может привести к злокачественному перерождению клетки. Большинство этих генов, называемых клеточными онкогенами или протоонкогенами, кодируют белки, участвующие в пролиферации и дифференцировке клеток. Протоонкогены, открытые в числе первых, получили названия тех видов позвоночных, у которых онкогенные вирусы с гомологичными протоонконкогенам генами вызывали опухоли. В опухолях человека активация протоонкогенов возможна вследствие хромосомных транслокаций, точечных мутаций и амплификации. При гемобластозах активация протоонкогенов чаще всего обусловлена хромосомными транслокациями, результатом которых бывают либо количественные (обычно при остром лимфобластном лейкозе), либо качественные изменения экспрессии генов. Количественные изменения обычно возникают, когда транслокация затрагивает локусы генов иммуноглобулинов (тяжелых цепей, легких k- и l- цепей) или антигенраспознающих рецепторов Т-лимфоцитов (a-,b,g- и d–цепей). Качественные изменения возникают вследствие образования химерного гена- то есть гена, состоящего из частей двух затронутых транслокаций генов и кодирующего один химерный белок. Примерами химерных генов могут служить ген BCR- ABL 1 при хроническом миелолейкозе, ген PML- RARA при остром промиелоцитарном лейкозе (вариант М3 по классификации FAB) и ген E2A- PBX1 при пре-В-лимфобластном лейкозе.
Гены – супрессоры опухолевого роста в норме осуществляют тормозной контроль за пролиферацией клеток. Следовательно, утрата этих генов (вследствие делеции) или их инактивация (в результате мутаций в обоих аллеях) может привести к бесконтрольной пролиферации. Избыточная экспрессия генов третьей группы, в частности гена BCL2, кодирующего белок наружной мембраны митохондрий, способствует канцерогенезу путем блокады апоптоза.
Хромосомы
Для идентификации хромосом прибегают к дифференциальному окрашиванию и флюоресцентной гибридизации in situ
Теломеры
Теломеры – это концевые участки хромосом, которые содержат повторяющиеся последовательности ДНК и укорачиваются с каждой репликацией. В самообновляющихся и активно делящихся популяциях клеток (например, стволовых клетках) действует фермент теломераза, способный наращивать теломерные последовательности и тем самым компенсировать их частичную потерю. От степени сохранности теломер зависит пролиферативный потенциал клетки; в опухолевых клетках длина теломер обычно поддерживается на постоянном уровне.
Рис.1.1
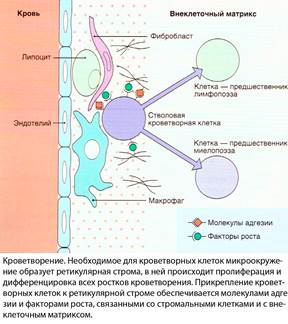
Рис.1.2

Рис.1.3
РАЗДЕЛ II
АНЕМИИ
Анемия – это синдром, либо самостоятельное заболевание, характеризующееся понижением содержания в крови гемоглобина, которое как правило сопровождается понижением содержания эритроцитов. Клиническая симптоматика характеризуется общими признаками для всех видов анемий: головокружение, шум в ушах, слабость, обмороки. Анемиями страдает примерно от 10 до 20% всего населения земли, из них 30% женщины и 50% дети.
Классификация анемий:
1. По типу эритропоэза выделяет нормобластические и мегалобластические анемии.
2. По диаметру эритроцитов выделяют нормоцитарные анемии (7,5-8,5 мкм); макроцитарные анемии (более 8,5 мкм); микроцитарные анемии (менее 7,5 мкм).
3. По цветовому показателю выделяют нормохромные анемии (0,85-1,05), гипохромные (менее 0,85) и гиперхромные (более 1,05).
Цветовой показатель рассчитывается по формуле: 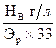 .
.
4. По регенераторной способности красного костного мозга выделяют: регенераторные анемии – 0,8-10% ретикулоцитов, гиперрегенаторные – более 10% ретикулоцитов и гипорегенераторные – менее 10% ретикулоцитов. В норме содержание ретикулоцитов составляет от 0,2 до 1%.
5. По этиопатогенезу выделяют анемии:
а)вследствии кровопотери. К ним относятся острая постгеморрагическая и хроническая постгеморрагическая анемии.
б)вследствии нарушенного кровообразования: железодефицитная, В12 и фолиеводефицитная, гипо- и апластическая анемии.
в)вследствии избыточного кроворазрушения: наследственные и приобретенные гемолитические анемии.
Практически при всех видах анемий имеет место качественное изменение со стороны эритроцитов. К ним относятся: анизоцитоз, пойкилоцитоз, анизохромия, наличие патологических включений в эритроцитах (тельца Жолли и кольца Кебота), базофильная пунктация, в следствии коагуляции белков цитоплазмы, сидероциты и сидеробласты.
Характеристика отдельных видов анемий.
Острая постгеморрагическая анемия развивается при одномоментной кровопотери более 10% объема циркулирующей крови. Этиология: травмы, внематочная беременность с разрывом трубы, гемофилия. В развитии ОПГА выделяют три фазы:
1-я фаза – кратковременный спазм, обусловлен выбросом катехоламинов.
2-я фаза – гидремической компенсации. Характеризуется увеличением ОЦК в результате задержки жидкости в кровеносном русле. Это происходит в результате активации ренин – ангиотензиновой системы. Схема которой следующая: ишемия юкстагломерулярного аппарата почек ® выброс ренина ®--> активация ангиотензиногена и превращение его в ангиотензин-1, превращение ангиотензина I в ангиотензин-2 под действием АПФ ® усиление синтеза альдостерона ® задержка натрия® усиление выброса антидиуретического гормона ® задержка воды ® увеличение ОЦК.
3-я фаза – костномозговой компенсации, характеризуется усилением выработки эритропоэтинов в почках и активацией костномозгового кроветворения. Эта фаза формируется примерно через неделю после кровопотери. Полное восстановление картины крови происходит спустя 4-6 недель.
Гематологическая характеристика картины крови при ОПГА: анемия нормобластическая, нормоцитарная, нормо- или легкая гипохромная, регенераторная, с умеренным анизо и пойкилоцитозом.
Железодефицитная анемия. Характеризуется истощением депо железа в организме. В организме взрослого человека содержится от 4 до 5 грамм железа. При этом 70% приходится на долю гемоглобина, 25% на долю ферритина и гемосидерина, 4% на долю миоглобина и 1% на долю цитохромов.
Этиология:
1. Недостаточное поступление железа с пищей. В норме с пищей поступает 15-20 мг. железа, но всасывается из них только 1-2 мг. Полностью усваивается железо содержащееся в мясе, так как оно двухвалентное. Железо содержащееся во фруктах может усваиваться только с аскорбиновой кислотой, так как оно трехвалентное.
2. Недостаточное всасывание железа из кишечника.
3. Дефицит трансферрина (наследственный или приобретенный).
4. Избыточное потребление железа плодом при беременности.
5. Хронические кровопотери.
6. Избыточное поглощение железа гельминтами.
Более подробно причины дефицита железа будут рассмотрены ниже.
Ежедневно для синтеза гемоглобина требуется примерно 25 мг железа. 1 мг поступает с пищей и 24 мг поступает из депо. Развитию гематологической картины железодефицитной анемии предшествует железодефицитное состояние, которое характеризуется снижением содержания сывороточного железа. Основным клиническим проявлением железодефицитного состояния является пикохлоротика, которая проявляется извращением вкуса и обоняния.
Клиника железодефицитной анемии. Для железодефицитной анемии характерны следующие клинические синдромы: гемический, трофических нарушений, иммунодефицитное состояние.
Гематологическая характеристика: нормобластическая, микроцитарная, гипохромная, гипорегенаторная анемия, сопровождающаяся лейкопенией, пониженным содержанием в крови сывороточного железа (норма 9-31 мкм/л) и увеличением общей железосвязывающей способности крови за счет увеличенного содержания свободного трансферрина (норма 45-75 мкм/л).
Разновидностью железодефицитной анемии является сидероахристическая анемия, при которой нарушается включение железа в молекулу гема. Эта анемия характеризуется повышенным содержанием сывороточного железа и снижением общей железосвязывающей способности крови.
Картина крови и костного мозга
В мазке крови обнаруживают гипохромию и микроцитоз, а также пойкилоциты (обычно в виде сигары) и иногда – мишеневидные эритроциты (см. 2.1). Выраженность изменений в мазке крови, а также степень снижения среднего эритроцитарного объема и среднего содержания гемоглобина в эритроците соответствует тяжести анемии. Число тромбоцитов обычно повышено, особенно при кровопотере.
Костный мозг характеризуется нормальной клеточностью, в ряде случаев наблюдается гиперплазия эритроидного ростка. Для предшественников эритроцитов характерны неровные контуры и вакуолизация цитоплазмы. Окраска по Перльсу выявляет полное отсутстви