Тема 4. Биокатализ. Представление о ферментах, классификация ферментов
Классификация и номенклатура ферментов
В основу классификации легли 3 принципа: химическая природа фермента; химическая природа субстрата, на который действует фермент; тип катализируемой реакции.
Согласно современной классификации, ферменты делят на шесть классов.
1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции:
Наиболее распространены следующие рабочие названия подкласов оксидоредуктаз:
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Наиболее распространены дегидрогеназы, содержащие в качестве активной группы никотинамидадениндинуклеотид (НАД+), никотинамидадениндинуклеотидфосфат (НАДФ), флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД).
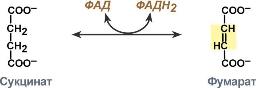 | |||
 | |||
2. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата. Например, на внутренней мембране митохондрий расположена дыхательная цепь – ферментный комплекс (метаболон), благодаря работе которого происходит синтез АТФ. В составе четвёртого комплекса дыхательной цепи присутствует фермент цитохромоксидаза, которая переносит электроны от восстановленных коферментов на кислород, катализируя реакцию синтеза метаболической воды: О2 + 4 е– + 4 Н+ ® 2 Н2О

3. Монооксигеназы (гидроксилазы) – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
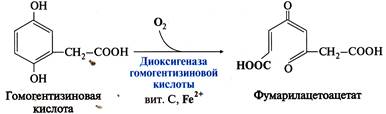
4. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.

5. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов (окислителя).
6. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
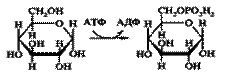 2. Трансферазы – ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов.
2. Трансферазы – ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов.
Фосфотрансферазы- перенос остатка фосфорной кислоты.
Фосфорные эфиры органических соединений обладают повышенной
химической активностью. Донором фосфатных остатков в большинстве
случаев является АТФ.
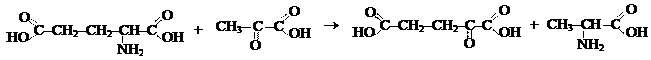 Аминотрансферазы ускоряют реакцию переноса аминогруппы от аминокислоты на a-кетокислоту (реакции трансаминирования).
Аминотрансферазы ускоряют реакцию переноса аминогруппы от аминокислоты на a-кетокислоту (реакции трансаминирования).
Протеинкиназы ускоряют перенос остатка фосфата с АТФ на белки,изменяя их биологическую активность. Реакция фосфорилирования широко используется для регуляции активности ферментов. Например, фосфорилированная молекула фермента может быть активна, а дефосфорилированная – нет.
Ацилтрансферазы катализируют перенос ацилов (остатков кислот).
3. Гидролазы – ускоряют реакции гидролиза (при участии воды). При этом продукты реакции имеют более простое строение, чем субстрат. Подклассы гидролаз: эстеразы, фосфатазы, гликозидазы, пептидазы.
Эстеразы катализируют гидролиз сложных эфиров спиртов с органическими и неорганическими кислотами. Например, липаза ускоряет гидролиз триацилглицеринов (жиров):
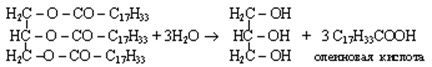 |
Фосфатазы катализируют гидролиз фосфорных эфиров:
глюкозо-6-фосфат + Н2О ® глюкоза + Н3РО4
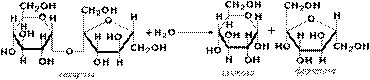 Гликозидазы катализируют гидролиз гликозидов. Из гликозидаз, действующих на полисахариды (крахмал, гликоген), наиболее известны амилазы, сахарозу гидролизует сахараза, лактозу – лактаза,
Гликозидазы катализируют гидролиз гликозидов. Из гликозидаз, действующих на полисахариды (крахмал, гликоген), наиболее известны амилазы, сахарозу гидролизует сахараза, лактозу – лактаза,
мальтозу – мальтаза.
Пептидгидролазы (пептидазы) ускоряют гидролиз пептидных связей в белках и пептидах: пепсин, трипсин, химотрипсин, эластаза, карбоксипептидаза.
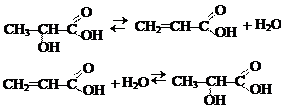 4. Лиазы – ферменты, катализирующие разрыв связей С–О, С–С, С–N и других, а также обратимые реакции отщепления - присоединения различных групп от субстратов негидролитическим путем. Эти реакции сопровождаются образованием двойной связи и выделением таких простейших продуктов, как СО2, H2O, NH3 и т.д. Реакции декарбоксилирования катализируют декарбоксилазы; дезаминирования – дезаминазы.
4. Лиазы – ферменты, катализирующие разрыв связей С–О, С–С, С–N и других, а также обратимые реакции отщепления - присоединения различных групп от субстратов негидролитическим путем. Эти реакции сопровождаются образованием двойной связи и выделением таких простейших продуктов, как СО2, H2O, NH3 и т.д. Реакции декарбоксилирования катализируют декарбоксилазы; дезаминирования – дезаминазы.
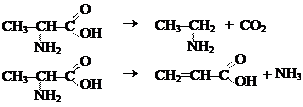 |
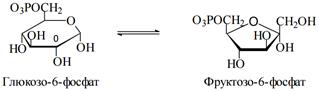 5. Изомеразы - ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров.
5. Изомеразы - ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров.
6. Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ либо других веществ.
Одной из важнейших карбоксилаз является пируваткарбоксилаза:
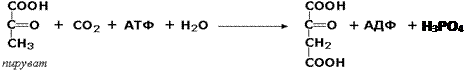 |
Ферменты имеют белковую природу. Небелковая часть ферментов, относящихся к сложным белкам, называется кофермент. В состав коферментов часто входят витамины.
Отличия ферментов от небиологических катализаторов заключаются в том, что скорость и селективность ферментативных реакций выше; ферменты обладают высокой специфичностью; скорость ферментативной реакции может регулироваться. Оптимальная температура действия ферментов 37 °С, при повышении температуры скорость ферментативной реакции начинает снижаться из-за денатурации фермента. При понижении температуры активность ферментов снижается, но не исчезает совсем (например, у животных, впадающих в спячку). Для каждого фермента есть оптимальное значение рН. При уменьшении или увеличении рН активность фермента снижается.
Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри.