| Вещество | Состояние | 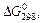 кДж/моль кДж/моль
| Вещество | Состояние | 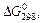 кДж/моль кДж/моль
|
| BaCO3 CaCO3 Fe3O4 BeCO3 CaO BeO BaO CO2 NaCl ZnO TiO2 | К К К К К К К Г К К К | -1138,8 -1128,75 -1014,2 -944,75 -604,2 -581,61 -528,4 -394,38 -384,03 -318,2 -888,6 | FeO H2O H2O PbO2 CO CH4 NO2 NO C2H2 TiO2 NaF | К Ж Г К Г Г Г Г Г К К | -244,3 -237,19 -228,59 -219,0 -137,27 -50,79 +51,84 +86,69 +209,20 -888,6 -541 |
Стандартные абсолютные энтропии 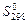 некоторых веществ
некоторых веществ
| Вещество | Состояние | 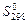 , Дж/(моль·К) , Дж/(моль·К)
| Вещество | Состояние | 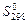 , Дж/(моль·К) , Дж/(моль·К)
|
| C C Fe Ti S TiO2 FeO H2O Fe2O3 NH4Cl CH3OH H2 Fe3O4 CH4 HCl | Алмаз Графит К К Ромб К К Ж К К Ж Г К Г Г | 2,44 5,69 27,2 30,7 31,9 50,3 54,0 69,94 89,96 94,5 126,8 130,59 146,4 186,19 186,68 | H2O N2 NH3 CO C2H2 O2 H2S NO CO2 C2H4 Cl2 NO2 PCl3 PCl5 TiO2 Ti | Г Г Г Г Г Г Г Г Г Г Г Г Г Г К К | 188,72 191,49 192,50 197,91 200,82 205,03 205,64 210,20 213,65 219,45 222,95 240,46 311,66 352,71 50,2 30,7 |
Контрольные вопросы
61. Вычислите 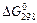 для следующих реакций (
для следующих реакций (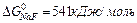 ):
):
а) 2NaF(к) + С12(г) = 2NaCl(к) + F2(г)
б) РbО2(к) + 2Zn(к) = Рb(к) + 2ZnО(к)
Можно ли получить фтор по реакции (а) и восстановить РbО2 цинком по реакции (б)? Ответ: + 313,94 кДж; -417,4 кДж.
62. При какой температуре наступит равновесие системы
4НС1(г) + О2(г) ↔ 2Н2О(г) + 2Сl2(г); ΔH = -114,42 кДж?
Хлор или кислород в этой системе является более сильным окислителем и при каких температурах? Ответ: 891 К.
63. Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4(к) + CO(г) = 3FeO(к) + СО2(г).
Вычислите 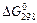 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно
и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно 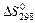 в этом процессе?
в этом процессе?
Ответ: +24,19 кДж; +31,34 Дж/(моль·К).
64. Реакция горения ацетилена идет по уравнению
С2Н2(г) + 5/2О2(г) = 2СО2(г) + Н2О(ж)
Вычислите 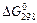 и
и 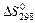 . Объясните уменьшение энтропии в результате этой реакции. Ответ: -1235,15 кДж; -216,15 Дж/(моль·К).
. Объясните уменьшение энтропии в результате этой реакции. Ответ: -1235,15 кДж; -216,15 Дж/(моль·К).
65. Уменьшается или увеличивается энтропия при переходах:
а) воды в пар; б) графита в алмаз? Почему? Вычислите 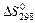 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
Ответ: а) 118,78 Дж/(моль·К); б) -3,25 Дж/(моль·К).
66. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция
Н2(г) + СО2(г) = СО(г) + Н2О(ж); ΔН = -2,85кДж?
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите 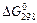 этой реакции.
этой реакции.
Ответ: +19,91 кДж.
67. Прямая или обратная реакция будет протекать при стандартных условиях в системе
2NO(г) + О2(г) ↔ 2NО2(г)
Ответ мотивируйте, вычислив 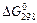 прямой реакции.
прямой реакции.
Ответ: -69,70 кДж.
68. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите 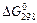 реакции, протекающей по уравнению
реакции, протекающей по уравнению
NH3(г) + HCl(г) = NH4Cl(к)
Может ли эта реакция при стандартных условиях идти самопроизвольно? Ответ: -92,08 кДж.
69. При какой температуре наступит равновесие системы
СО(г) + 2Н2(г) ↔ СН3ОН(ж); ΔН = -128,05 кДж?
Ответ: ≈ 385,5 К.
70. При какой температуре наступит равновесие системы
СН4(г) + СО2(г)= 2СО(г) + 2Н2(г); ΔН = +247,37 кДж?
Ответ: ≈ 961,9 К.
71. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите 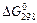 реакции, протекающей по уравнению
реакции, протекающей по уравнению
4NН3(г) + 5O2(г) = 4NO(г) + 6Н2О(г).
Возможна ли эта реакция при стандартных условиях?
Ответ: - 957,77 кДж.
72. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите 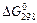 реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж)
Возможна ли эта реакция при стандартных условиях?
Ответ: - 130,89 кДж.
73. Вычислите 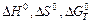 реакции, протекающей по уравнению
реакции, протекающей по уравнению
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г)
Возможна ли реакция восстановления Fе2О3 водородом при температурах 500 и 2000 К?
Ответ: + 96,61 кДж; 138,83 Дж/К; 27,2 кДж; – 181,05 кДж.
74. Какие из карбонатов: ВеСО3 или ВаСО3 – можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив 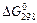 реакций.
реакций.
Ответ: + 31,24 кДж; - 130,17 кДж; – 216,02 кДж.
75. На основании стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ вычислите 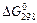 реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО(г) + 3Н2(г) = СН4(г) + Н2О(г)
Возможна ли эта реакция при стандартных условиях?
Ответ: - 142,16 кДж.
76. Вычислите 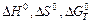 реакции, протекающей по уравнению
реакции, протекающей по уравнению
ТiO2(к) + 2С(к) = Тi(к) + 2СО(г)
Возможна ли реакция восстановления ТiO2 углеродом при температурах 1000 и 3000 К?
Ответ: + 722,86 кДж; 364,84 Дж/К; + 358,02 кДж; - 371,66 кДж.
77. На основании стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ вычислите 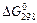 реакции, протекающей по уравнению С2Н4(г) + 3O2(г) = 2СО2(г) + 2Н2О(ж)
реакции, протекающей по уравнению С2Н4(г) + 3O2(г) = 2СО2(г) + 2Н2О(ж)
Возможна ли эта реакция при стандартных условиях?
Ответ: - 1331,21 кДж.
78. Определите, при какой температуре начнется реакция восстановления Fе3О4, протекающая по уравнению
Fe3O4(к) + СО(г) = 3FeO(к) + СО2(г); ΔН = + 34,55 кДж.
Ответ: 1102,4 К.
79. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению
РСl5(г) = РС13(г) + С12(г); ΔН = + 92,59 кДж.
Ответ: 509 К.
80. Вычислите изменение энтропии для реакций, протекающих по уравнениям:
2СН4(г) = С2Н2(г) + 3Н2(г);
N2(г) + 3H2(г) = 2NH3(г);
С(графит) + О2(г) = СО2(г).
Почему в этих реакциях 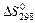 > 0; < 0; ≈ 0?
> 0; < 0; ≈ 0?
Ответ: 220,21 Дж/К; - 198,26 Дж/К; 2,93 Дж/К.
Тема 5. Химическая кинетика и равновесие
Контрольные вопросы
81. Окисление серы и ее диоксида протекает по уравнениям:
а) S(к) + О2 = SO2(к); б) 2SO2(г) + O2 = 2SO3(г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
82. Напишите выражение для константы равновесия гомогенной системы N2 + 3Н2 ↔ 2NН3. Как изменится скорость прямой реакции - образования аммиака, если увеличить концентрацию водорода в три раза?
83. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были: [N2] = 0,049 моль/л; [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005 моль/л. Ответ: [N2] = 0,0465 моль/л; [О2] = 0,0075 моль/л.
84. Реакция идет по уравнению N2 + 3H2 = 2NH3. Концентрации участвующих в ней веществ были: [N2] = 0,80 моль/л; [Н2] = 1,5 моль/л; [NН3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л. Ответ: [NH3] = 0,70 моль/л; [H2] = 0,60 моль/л.
85. Реакция идет по уравнению Н2 + I2 = 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2] = 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2] = 0,03 моль/л.
Ответ: 3,2·10-4; 1,92·10-4.
86. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 800С. Температурный коэффициент скорости реакции 3.
87. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 600С, если температурный коэффициент скорости данной реакции 2?
88. В гомогенной системе СО + Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО.
Ответ: K = 20; [Сl2]ИСХ= 1,5 моль/л; [СО]ИСХ= 1,4 моль/л.
89. В гомогенной системе А + 2В ↔ С равновесные концентрации реагирующих газов: [A] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 2,5; [А]ИСХ= 0,276 моль/л; [В]ИСХ=0,552 моль/л.
90. В гомогенной газовой системе А + В ↔ С + D равновесие установилось при концентрациях: [В] = 0,05 моль/л и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А]ИСХ= 0,22 моль/л; [В]ИСХ= 0,07 моль/л.
91. Константа скорости реакции разложения N2О, протекающей по уравнению 2N2O = 2N2 + О2, равна 5·10-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, к моменту разложения 50% N2O. Ответ: 1,8·10-2; 4,5·10-3.
92. Напишите выражение для константы равновесия гетерогенной системы СО2 + С ↔ 2СО. Как изменится скорость прямой реакции - образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
93. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции - образования водяных паров?
94. Равновесие гомогенной системы
4HCl(г) + O2 ↔ 2Н2О(г) + 2С12 (г)
установилось при следующих концентрациях реагирующих веществ: [Н2О]P= = 0,14 моль/л; [С12]P = 0,14 моль/л; [НСl]P = 0,20 моль/л; [О2]P = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [НСl]ИСХ =0,48,моль/л; [О2]ИСХ = 0,39 моль/л.
95. Вычислите константу равновесия для гомогенной системы
СО(г) + Н2О(г) ↔ CО2(г) + Н2(г)
если равновесные концентрации реагирующих веществ: [СО]Р= 0,004 моль/л; [Н2О]Р = 0,064 моль/л; [СО2]Р = 0,016 моль/л; [Н2]Р = 0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: К = 1; [Н2О]ИСХ =0,08 моль/л; [СО]ИСХ = 0,02 моль/л.
96. Константа равновесия гомогенной системы СО(г) + Н2О(г) ↔ СО2 + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО]ИСХ = 0,10 моль/л; [Н2О]ИСХ = 0,40 моль/л. Ответ: [СО2]Р = [Н2]Р = 0,08 моль/л; [СО]Р = 0,02 моль/л; [Н2О]Р = 0,32 моль/л.
97. Константа равновесия гомогенной системы N2 + 3Н2 ↔ 2NН3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: [N2]P = 8 моль/л;[N2]ИСХ =8,04 моль/л.
98. При некоторой температуре равновесие гомогенной системы 2NO + О2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO]Р = 0,2 моль/л; [О2]Р = 0,1 моль/л; [NO2]Р = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2.
Ответ: К = 2,5; [NО]ИСХ = 0,3 моль/л; [О2]ИСХ = 0,15 моль/л.
99. Почему при изменении давления смещается равновесие системы N2 + 3H2 ↔ 2NH3 и не смещается равновесие системы N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
100. Исходные концентрации [NО]ИСХ и [Сl2]ИСХ в гомогенной системе 2NO + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416.
Тема 6. Способы выражения концентрации раствора
Контрольные вопросы
101. Вычислите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция плотностью 1,178 г/см3. Ответ: 2,1 М; 4,2 н.
102. Чему равна нормальность 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. Ответ: 9,96 н.; 6,3%.
103. К 3 л 10%-ного раствора HNO3 плотностью 1,054 г/см3 прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрацию полученного раствора, объем которого равен 8 л. Ответ: 5,0%; 0,82 М.
104. Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора HNO3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Ответ: 3,70 н.; 4,17 м; 931,8 г.
105. Вычислите молярную, эквивалентную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3. Ответ: 1,38 М; 4,14 н.; 1,43 м.
106. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора H2SO4 прибавить 125 см3 0,2 н. раствора КОН? Ответ: 0,14 г КОН.
107. Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, потребовалось 50 см3 0,2 н. раствора HCl. Какова нормальность раствора AgNO3? Какая масса AgCl выпала в осадок? Ответ: 0,1 н.; 1,433 г.
108. Какой объем 20,01%-ного раствора HCl (пл. 1,100 г/см3) требуется для приготовления 1л 10,17%-ного раствора (пл. 1,050 г/см3)? Ответ: 485,38 см3.
109. Смешали 10 см3 10%-ного раствора HNO3 (пл. 1,056 г/см3) и 100 см3 30%-ного раствора HNO3 (пл. 1,184 г/см3). Вычислите процентную концентрацию полученного раствора. Ответ: 28,38%.
110. Какой объем 50%-ного раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (пл. 1,048 г/см3)? Ответ: 245,5 см3.
111. Какой объем 10%-ного раствора карбоната натрия (пл. 1,105 г/см3) требуется для приготовления 5 л 2%-ного раствора (пл. 1,02 г/см3)? Ответ: 923,1 см3.
112. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны нормальность и титр раствора H2SO4? Ответ: 0,023 н.; 1,127·10-3 г/см3.
113. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ: 26,6 см3.
114. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты. Ответ: 0,53 н.
115. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Каков титр раствора NaOH? Ответ: 0,882 г, 0,016 г/см3.
116. Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
117. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна процентная концентрация полученного раствора? Ответ: 32,5%.
118. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора? Ответ: 45,72%.
119. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? Ответ: 84%.
120. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора? Ответ: 16,7%.
Тема 7. Свойства растворов
Контрольные вопросы
121. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,2960 С. Температура кристаллизации бензола 5,50 С. Криоскопическая константа 5,10. Вычислите мольную массу растворенного вещества. Ответ: 128 г/моль.
122. Вычислите процентную концентрацию водного раствора сахара C12H22O11, зная, что температура кристаллизации раствора -0,930 С. Криоскопическая константа воды 1,860. Ответ: 14,6%.
123. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,860. Ответ: -1,030 С.
124. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,7140 С. Температура кипения бензола 80,20 С. Вычислите эбуллиоскопическую константу бензола. Ответ: 2,570.
125. Вычислите процентную концентрацию водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,390 С. Эбуллиоскопическая константа воды 0,520. Ответ: 6,45%.
126. Вычислите мольную (молярную) массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,2790 С. Криоскопическая константа воды. 1,860. Ответ: 60 г/моль.
127. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,20 С. Эбуллиоскопическая константа его 2,570. Ответ: 81,25° С.
128. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,4650 С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,860. Ответ: 342 г/моль.
129. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,7180 С. Температура кристаллизации уксусной кислоты 16,650 С. Ответ: 3,90.
130. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,810С. Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая константа бензола 2,570. Ответ: 8.
131. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна – 0,5580 С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,860.
Ответ: 442 г/моль.
132. Какую массу анилина C6H5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,530. Эбуллиоскопическая константа этилового эфира 2,120. Ответ: 1,16 г.
133. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта С2Н5ОН. Криоскопическая константа воды 1,860. Ответ: -0,820 С.
134. Сколько граммов мочевины (NН2)2СО следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,4650? Криоскопическая константа воды 1,86°. Ответ: 1,12 г.
135. Вычислите процентную концентрацию водного раствора глюкозы C6H12O6, зная, что этот раствор кипит при 100,260 С. Эбуллиоскопическая константа воды 0,520. Ответ: 8,25%.
136. Сколько граммов фенола C6H5OH следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,70? Криоскопическая константа бензола 5,10. Ответ: 3,91 г.
137. Сколько граммов мочевины (NН2)2СО следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,260? Эбуллиоскопическая константа воды 0,520С. Ответ: 7,5 г.
138. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,3720. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,860С.
Ответ: 92 г/моль.
139. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбуллиоскопическая константа воды 0,520. Ответ: 101,520 С.
140. Вычислите процентную концентрацию водного раствора метанола CH3OH, температура кристаллизации которого -2,790 С. Криоскопическая константа воды 1,860. Ответ: 4,58%.
Тема 8. Ионно-молекулярные (ионные) реакции обмена
Контрольные вопросы
141. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) NaHCO3 и NaOH; б) K2SiO3 и НСl; в) BaCl2 и Na2SO4.
142. Составьте молекулярные и ионно-молекуляpные уравнения реакций взаимодействия в растворах между: a) K2S и HCl; б) FeSO4 и (NH4)2S; в) Сr(ОН)3 и КОН.
143. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Мg2+ + СO32- = МgСO3;
б) H+ + OH- = H2O.
144. Какое из веществ: Al(OH)3; H2SO4; Bа(ОН)2 - будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
145. Составьте молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) КНСО3 и H2SO4; б) Zn(OH)2 и NaOH; в) СаС12 и AgNO3.
146. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между a) CuSO4 и H2S; б) ВаСО3 и HNO3; в) FeCl3 и КОН.
147. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Сu2+ + S2- = CuS;
б) SiO32- + 2Н+ = H2SiO3.
148. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между a) Sn(OH)2 и HCl; б) BeSO4 и КОН; в) NH4Cl и Ва(ОН)2.
149. Какое из веществ: КНСО3, СН3СООН, NiSO4, Na2S – взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
150. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) AgNO3 и К2СгО4; б) Pb(NO3)2 и KI; в) CdSO4 и Na2S.
151. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) СаСО3 + 2Н+ = Са2+ + Н2О + СО2;
б) А1(ОН)3 + ОН- = АlO2- + 2Н2O;
в) Рb2+ + 2I- = РbI2.
152. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Ве(ОН)2 и NaOH; б) Сu(ОН)2 и HNO3; в) ZnOHNO3 и HNO3.
153. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и CaCl2; б) K2CO3 и BaCl2; в) Zn(OH)2 и KOH.
154. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O;
Cd2+ + 2OH- = Cd(OH)2;
H+ + NO2- = HNO2.
155. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CdS и HCl; б) Cr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2.
156. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Zn2+ + H2S = ZnS + 2H+;
б) HCO3- + H+ = H2O + CO2;
в) Ag+ + Cl- = AgCl.
157. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) H2SO4 и Ba(OH)2; б) FeCl3 и NH4OH; в) CH3COONa и HCl.
158. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и KOH; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3.
159. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Be(OH)2 + 2OH- = BeO22- + 2H2O;
б) CH3COO- + H+ = CH3COOH;
в) Ba2+ + SO42- = BaSO4.
160. Какое из веществ: NaCl, NiSO4, Be(OH)2, KHCO3 – взаимодействует с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
Тема 9. Окислительно-восстановительные реакции
Контрольные вопросы
161. Исходя из степени окисления хлора в соединениях HCl, НС1О3, НСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
КВr + КВrO3 + H2SO4 → Br2 + K2SO4 + Н2О.
162. Реакции выражаются схемами:
Р + НIO3 + Н2О → Н3РО4 + HI;
H2S + Cl2 + Н2О → H2SO4 + HCl.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
163. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
As3- → As5+; N3+ → N3-; S2- → S0.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + КОН.
164. Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O.
165. См. условие задачи 162.
Р + HNO3 + Н2О → Н3РО4 + NО;
KMnO4 + Na2SO3 + КОН → K2MnO4 + Na2SO4 + Н2О.
166. Составьте электронные уравнения и укажите, какой процесс - окисление или восстановление – происходит при следующих превращениях:
Мn6+ → Mn2+; Cl5+ → Cl-; N3- → N5+.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Cu2O + HNO3 → Cu(NO3)2 + NO + Н2О.
167. См. условие задачи 162.
HNO3 + Ca → NH4NO3 + Ca(NO3)2 + Н2О;
K2S + KMnO4 + H2SO4 → S + K2SO4 + MnSO4 + H2O.
168. Исходя из степени окисления хрома, иода и серы в соединениях К2Сr2О7, KI и H2SO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO2 + РbО2 + NaOH → Na2CrO4 + Na2PbO2 + Н2О.
169. См. условие задачи 162.
H2S + Сl2 + Н2О → H2SO4 + HCl;
K2Cr2O7 + H2S + H2SO4 → S+ Cr2(SO4)3 + K2SO4 + H2O.
170. См. условие задачи 162.
KClO3 + Na2SO3 → KCl + Na2SO4;
KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O.
171. См. условие задачи 162.
Р + HClO3 + Н2О → Н3РО4 + HCl;
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O.
172. Cм. условие задачи 162.
NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O;
FeS + HNO3 → Fe(NO3)2 + S + NO + H2O.
173. См. условие задачи 162.
HNO3 + Zn → N2O + Zn(NO3)2 + H2O;
FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O.
174. См. условие задачи 162.
К2Сr2О7 + HCl → Cl2 + CrCl3 + KCl + H2O;
Au + HNO3 + HCl → AuCl3 + NO + H2O.
175. Могут ли происходить окислительно-восстановительные реакции между веществами: а)NН3 и КМnО4; б) HNO2 и HI; в) HCl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
KМnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O.
176. См. условие задачи 162.
HCl + CrO3 → Cl2 + CrCl3 + H2O;
Cd + KMnO4 + H2SO4 → CdSO4 + MnSO4 + K2SO4 + H2O.
177. См. условие задачи 162.
Cr2O3 + KClO3 + KOH → K2CrO4 + KCl + H2O;
MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O.
178. См. условие задачи 162.
H2SO3 + HClO3 → H2SO4 + HCl;
FeSО4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O.
179. См. условие задачи 162.
I2 + Cl2 + H2O → HIO3 + HCl;
K2Cr2O7 + Н3РО3 + H2SO4 → Cr2(SO4)3 + Н3РO4 + K2SO4 + Н2О.
180. Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВr; б) К2Сr2О7 и Н3РО3; в) HNO3 и H2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
AsH3 + HNO3 → H3AsO4 + NO2 + H2O.
Т е м а 10. Электронные потенциалы и электродвижущие силы
Стандартные электродные потенциалы (Е°) некоторых металлов (ряд напряжений Н.Н.Бекетова)
| Электрод | E0, B | Электрод | E0, B |
| Li+/Li Rb+/Rb K+/K Cs+/Cs Ba2+/Ba Ca2+/Ca Na+/Na Mg2+/Mg Al3+/Al Ti2+/Ti Zr4+/Zr Mn2+/Mn V2+/V Cr2+/Cr Zn2+/Zn Cr3+/Cr Fe2+/Fe | -3,045 -2,925 -2,924 -2,923 -2,90 -2,87 -2,714 -2,37 -1,70 -1,603 -1,58 -1,18 -1,18 -0,913 -0,763 -0,74 -0,44 | Cd2+/Cd Co2+/Co Ni2+/Ni Sn2+/Sn Pb2+/Pb Fe3+/Fe 2H+/H2 Sb3+/Sb Bi3+/Bi Cu2+/Cu Cu+/Cu Hg22+/2Hg Ag+/Ag Hg2+/Hg Pt2+/Pt Au3+/Au Au+/Au | -0,403 -0,277 -0,25 -0,136 -0,127 -0,037 -0,000 +0,20 +0,215 +0,34 +0,52 +0,79 +0,80 +0,85 +1,19 +1,50 +1,70 |
Контрольные вопросы
181. Есть два сосуда с голубым раствором медного купороса. В первый поместили цинковую пластинку, а во второй – серебряную. В каком сосуде цвет раствора постепенно исчезает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
182. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: a) CuSO4; б) МgSO4; в) Рb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
183. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
184. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: a) AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
185. Марганцевый электрод в растворе его соли имеет потенциал – 1,23 В. Вычислите концентрацию ионов Мn2+ (в моль/л). Ответ: 1,89·10-12 моль/л.
186. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Аg+ (в моль/л)? Ответ: 0,20 моль/л.
187. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Cd2+] = 0,8 моль/л, а [Сu2+] = 0,01 моль/л. Ответ: 0,68 В.
188. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
189. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1,89·10-12 моль/л.
190. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3. Ответ: 0,059 В.
191. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод - в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
192. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
193. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
194. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
195. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
196. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3·10-15 моль/л.
197. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb.
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л, [Рb2+] = 0,0001 моль/л. Ответ: 0,064 В.
198. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
199. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий – никелевого аккумулятора?
200. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?