В полученном растворе определите концентрацию ионов никеля (II) комплексонометрическим титрованием с мурексидом.
Для этого отберите пипеткой 10 мл раствора никеля из стакана № 2 и перенесите его в коническую колбу для титрования. В эту же колбу добавьте 5 мл 10% раствора аммиака, измерив его объем с помощью мерного цилиндра, и 2/3 мерной фарфоровой ложки индикатора – мурексида. Смесь перемешайте и оттитруйте раствором трилона Б концентрацией 0,05 М до изменения окраски из желто-оранжевой в сиренево-малиновую в точке стехиометричности. Измерьте объем израсходованного на титрование раствора трилона Б. (Трилон Б – динатриевая соль этилендиаминтетрауксусной кислоты ЭДТА, C10H14O8N2Na2·2H2O, условная формула Na2H2Y). В реакции участвуют ионы – H2Y2-:
Ni2+ + H2Y2- = NiY2- + 2H+
Титрование проводят минимум дважды.
Оформление опыта
Результаты титрования запишите в таблицу № 3.
Запишите значения объёмов трилона Б и определите средний результат.
Рассчитайте массу m1 ионов никеля до сорбции, используя концентрацию исходного раствора сульфата никеля. Объем исходного раствора сульфата никеля равен 40 мл,  = 40 мл.
= 40 мл.
 =
=  ∙
∙ 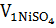 ∙
∙ 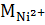
Рассчитайте концентрацию C2 ионов никеля в растворе после сорбции, используя закон стехиометрии:
 ∙
∙  = Стрилон Б ∙Vтрилон Б,
= Стрилон Б ∙Vтрилон Б,
где 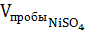 – объем пробы, взятый на титрование, 10 мл;
– объем пробы, взятый на титрование, 10 мл;
 =
=  , моль/л
, моль/л
Рассчитайте массу m2 ионов никеля в растворе после сорбции (объем раствора после сорбции практически не меняется,  =
=  ):
):
 =
=  ∙
∙  ∙
∙ 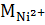 , г,
, г,
где:  - объем раствора после сорбции равный 40 мл;
- объем раствора после сорбции равный 40 мл;
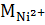 – молярная масса ионов никеля.
– молярная масса ионов никеля.
Рассчитайте массу сорбированного никеля,
m3 = m1 –m2
Результаты занесите в таблицу
Таблица 3
| Результаты титрования: | |
| V1трилона Б = … мл V2трилона Б = … мл Vсртрилона Б= … мл |  ∙ ∙  = Стрилон Б ∙Vтрилон Б = Стрилон Б ∙Vтрилон Б
 = = 
 = … моль/л = … моль/л
 = =  ∙ ∙  ∙ ∙ 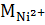
 = =  ∙ ∙  ∙ ∙ 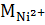 m3 – масса сорбированных катионов никеля
m3 = m1 –m2
m3 – масса сорбированных катионов никеля
m3 = m1 –m2
|
Рассчитайте коэффициент распределения ионов никеля между жидкой (электролит) и твердой (катионит) фазами по формуле:
Dтв/ж = m3/m2
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. На чем основан метод разделения меди и железа при взаимодействии с аммиаком? Предложите другой способ разделения меди и железа.
2. На чем основаны фотометрические методы определения концентрации растворов? Запишите закон Бугера-Ламберта-Бера.
3. Какая зависимость существует между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества и анализируемого иона?
4. Какие способы выражения концентрации вы знаете?
5. Какие растворы называют стандартными?
6. Что такое «холостая проба» в методе фотоколориметрического определения?
7. Запишите закон стехиометрии. Дайте определение точки стехиометричности (эквивалентности).
8. Какие методы титриметрии вы знаете? Какие реакции лежат в их основе?
9. Что такое проба? Приведите возможные причины неправильного отбора пробы исследуемого раствора.
10. Приведите примеры применения методов разделения и очистки химических соединений в атомной энергетике.