Открыть файл Formula2.mcd
В формуле функции распределения f(v) в данном файле введены другие обозначения: молярная масса - µ, абсолютная температура – t, универсальная газовая постоянная – r.
Подвести курсор ко второй строчке и установить температуру t =400.
В первой строчке установить молярную массу первого соединения. Из кривой распределения для данной молярной массы определить наиболее вероятную скорость v в. (Скорости v отложены вдоль оси абсцисс). Для этого подведите курсор к графику и нажмите правую клавишу мыши. В предложенных функциях выберите команду “след». (В англоязычной версии - «trace…»). Далее нажимаете левую клавишу мыши на максимуме графика и в появившейся таблице определите координату на оси X.
Провести подобную операцию для остальных объектов. Результаты измерений занести в Таблицу 3. Вычислить 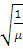 .
.
Таблица 3
| Молярная масса µ | ||||
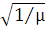
| ||||
| Наиболее вероятная скорость v в |
Построить график зависимости v в от величины 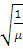 .
.
Анализ зависимости наиболее вероятной скорости молекул от температуры для данного газа.
Выберите одно из соединений. Установите во второй строчке его молярную массу. Проведите анализ зависимости v в от температуры в пределах того диапазона температур, которые указаны в Таблице 1. Диапазон разделите так, чтобы получилось 5 точек. Результаты запишите в Таблицу 4. Извлеките 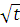 и вычислите отношение
и вычислите отношение 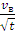 .
.
Таблица 4
| Соединение (укажите какое) | Температура t | |||||
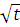
| ||||||
| Наиболее вероятная скорость v в | ||||||
отношение 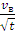
|
3. Расчет наиболее вероятной скорости (vв), средней квадратичной 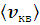 и средней арифметической скорости
и средней арифметической скорости 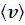 молекул азота. Определение доли молекул
молекул азота. Определение доли молекул 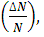 обладающих этими скоростями.
обладающих этими скоростями.
По формулам (4, 5, 6) вычислите скорости 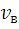 ,
, 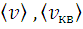 молекул азота для температуры t= 300 К. Результат занесите в Таблицу 5.
молекул азота для температуры t= 300 К. Результат занесите в Таблицу 5.
Проверьте условие нормировки функции (3*) для молекул азота, то есть возьмите интеграл в интервале скоростей, приведенном на графике функции распределения. (Предварительно введите параметры μ=28·10-3 , t=300). Нижний предел интегрирования установите равным 1. Результат запишите в Таблицу 5.
Используя рассчитанные значения скоростей, путем интегрирования определите доли молекул, имеющих скорости v в ± Δ v; 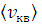 ± Δ v;
± Δ v; 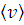 ± Δ v (где Δ v =5м/с). Для этого в формулу интеграла надо подставить нижний предел v -5 и в верхний v +5. Результат округлите до третьей значащей цифры и запишите в Таблицу 5.
± Δ v (где Δ v =5м/с). Для этого в формулу интеграла надо подставить нижний предел v -5 и в верхний v +5. Результат округлите до третьей значащей цифры и запишите в Таблицу 5.
Таблица 5
| v в |
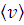
|
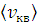
| Условие норми-ровки | v в±ΔV |
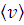 ±ΔV ±ΔV
|
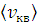 ±ΔV ±ΔV
|
| Значение интеграла в пределах диапазона скоростей (*10-2) |
Путем интегрирования определите относительное число молекул азота, которые имеют скорости, отличающиеся от v в в различных интервалах, указанных в Таблице 6.
Таблица 6
| Интервал скоростей | Числовые значения интервала скоростей | 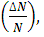 % %
|
| 1 - 0,5∙ v в | ||
| (0,5 - 1)∙ v в | ||
| (1 - 1,5)∙ v в | ||
| (1,5 - 2)∙ v в | ||
| (2 - 3)∙ v в | ||
| (3 - 5)∙ v в | ||
| (5 - 10)∙ v в |
Из полученных данных определите:
a) Сколько процентов молекул имеют скорости, отличающиеся от v в не более чем на 50%.
б) Найдите отношение доли молекул, определенных в пункте а) к доли молекул, скорости которых более чем в 5 раз превышают наиболее вероятную скорость. Результаты укажите в Таблице 7.
Таблица 7
| Данные расчета пункта а) | Данные расчета пункта б) |
4. Сопоставление результатов расчетов, полученных с использованием калькулятора и путем интегрирования.
Воспользовавшись формулами (4) и (7), рассчитайте с помощью калькулятора долю молекул азота при температуре Т = 300 К, обладающих скоростями в интервале от v до v +Δ v. Интервал скоростей приведен в таблице 8.
Таблица 8
| № варианта | Интервал скоростей (м/с) | № варианта | Интервал скоростей (м/с) |
| 100 - 110 | 200-210 | ||
| 150-160 | 102 - 112 | ||
| 300-310 | 155-165 | ||
| 395-405 | 300-310 | ||
| 190-200 | 295-305 | ||
| 110-120 | 190-200 | ||
| 115 - 125 | 150-160 | ||
| 155-165 | 340-350 | ||
| 335-345 | 375-395 | ||
| 345 - 355 | 195-205 | ||
| 192-202 | 170-180 | ||
| 108 - 118 | 285-295 | ||
| 109-119 | 158-168 | ||
| 364-374 | 300-310 | ||
| 390-400 | 393-403 | ||
| 190-200 | 100 - 110 |
Для удобства результаты промежуточных расчетов и окончательный результат занесите в таблицу 9. Проведите расчет с помощью интегрирования в этом же интервале скоростей. Результат запишите в таблицу. Оцените погрешность расчетов, проведенных двумя методами.
Таблица 9
| Числовое значение интервала скоростей | Vв | U2 |
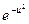
| ΔU | 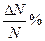 (калькулятор)
(калькулятор)
| 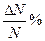 (интеграл)
(интеграл)
|
Вопросы
1) Какой физический смысл абсолютной температуры Т и универсальной газовой постоянной R?
2) Как влияет давление и объем газа на распределение молекул по скоростям?
3) Чему соответствует наиболее вероятная скорость молекул на графике функции распределения?
4) Получите из функции распределения молекул по скоростям функцию распределения по энергиям.
5) Исходя из функции распределения молекул по скоростям (формула 2), выведите закон, выражающий распределение молекул по относительным скоростям U (U=  ) (формула 7).
) (формула 7).