Октября 2021 г. (пятница)
Дисциплина: Химия
Группа: № 78
Урок №16
Литература: Рудзитис Г. Е. Химия. 11 класс: учеб. для общеобразоват. организаций с прил. на электрон. носителе базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 2014. – 224 с.
Материалы урока:
Повторить теоретический материал стр. 114-116
Тема: Кислоты. Химические свойства кислот. Кислоты-окислители. Специфические свойства концентрированной серной и азотной кислот.
видеоурок https://www.youtube.com/watch?v=Td6itaNfJrU
Задание: Написать тему (тема прилагается), выучить, ответить на вопросы.
Цель: Рассмотреть кислоты. Химические свойства кислот. Кислоты-окислители. Изучить свойства концентрированной серной и азотной кислот, действие ее на металлы, стоящие в электрохимическом ряду до и после водорода.
Задачи:
1. Обобщить знания обучающихся о кислоте; способствовать развитию умения мыслить логически и владеть химическим языком;
2. Развить навыки наблюдения, умения выделять главное, сравнивать изучаемые факты, делать выводы;
3. Воспитывать умения работать самостоятельно с применением само- и взаимоконтроля. Показать связь изучаемой темы с жизнью. Воспитывать научное мировоззрение на основе взаимосвязи свойств и строения.
ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ
1. Очень сильная кислота. Индикаторы в её растворе изменяют цвет на красный.
Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
K2O + 2H+ + 2NO3- → 2K+ + 2NO3- + H2O
K2O + 2H+ → 2K+ + H2O
Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
H+ + OH- → H2O
Реагирует с солями, вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32- → H2O + CO2
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота - сильный окислитель
N+5 → N+4→ N+2→ N+1→ No → N-3
N+5 + 8e-→N-3 окислитель, восстанавливается.
Разлагается на свету и при нагревании
4HNO3 t˚C→ 2H2O + 4NO2 + O2
Образуется бурый газ
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
Реагирует с металлами.
В зависимости от концентрации кислоты и положения металла в электрохимическом ряду напряжений Н. Бекетова могут образовываться разные азотсодержащие продукты.
При взаимодействии с металлами никогда не выделяется водород
HNO3 + Me = соль + H2O + Х
Концентрированная серная кислота
Очень сильный окислитель. Не реагирует с Au и Pt.В обычных условиях реагирует со всеми металлами, кроме Fe, Al, Cr, потому что они пассивируются в ней, чтобы запустить реакцию, нужно нагревание. Концентрированная серная кислота окисляет металлы до более высоких степеней окисления (Fe+3,Cr+3,Mn+4)Концентрированная серная кислота восстанавливается до различных степеней окисления и соответствующих ей при этих степенях соединений.
С металлами, стоящими в ряду напряжения до Al (включительно) реакция идёт по схеме:
Металл+ кислота→соль+H2 S↑+H2O
8Al+15H2 SO4 (конц.)→4Al2 (SO4)3+3H2S↑+12H2O
С металлами, стоящими в ряду напряжения после Al и до Cr (включительно) реакция идёт по схеме:
Металл+кислота→соль + S↓+H2O
2Cr+4H2 SO4 (конц.)→Cr2 (SO4)3+S↓+4H2S↑
С металлами, стоящими в ряду напряжений после Cr (кроме Ptи Au) реакция идёт по схеме:
Металл+кислота→соль+SO2+H2O
2Fe+6H2 SO4 (конц.)→Fe2 (SO4)3+3SO2↑+6H2O
Концентрированная серная кислота реагирует с некоторыми неметаллами, окисляя их до максимальной степени окисления, а сама восстанавливается до SO2:
C+2H2 SO4 (конц.)→CO2↑+2SO2↑+2H2O
Концентрированная серная кислота окисляет йодид и бромид-ионы до свободных галогенов:
2KI+2H2 SO4→K2 SO4+SO2↑+I2↓+2H2O
Концентрированная серная кислота не может окислять хлорид-ионы до свободного галогена, реакция идёт по другой схеме:
NaCl+H2 SO4 (конц.)→NaHSO4+HCl
Азотная концентрированная кислота
Азотная концентрированная кислота взаимодействует с металлами:
Общая схема всех реакций азотной кислоты с металлами (концентрация значения не имеет):
Кислота + металл → соль + газ + вода
С малоактивными металлами азотная концентрированная кислота восстанавливается до NO2.
Cu+4HNO3→Cu(NO3)2+2NO2↑+2H2O
С щелочными и щелочноземельными азотная концентрированная кислота восстанавливается до N2O.
4Ca+10HNO3→4Ca(NO3)2+N2O↑+5H2O
Fe, Cr, Al пассивируются.
Реагирует с неметаллами:
Концентрированная азотная кислота окисляет неметаллы до их высших кислот, а сама восстанавливается до оксидов азота (II,если кислота разбавленная. IV, если кислота концентрированная).
S+6HNO3 (конц.)→H2 SO4+6NO2↑+2H2O
Смесь соляной и азотной кислот называется “царской водкой”. Она способна растворять платину и золото.
HNO3+4HCl+Au→H[AuCl4 ]+NO↑+2H2O
4HNO3+18HCl+Pt→3H2 [PtCl6 ]+4NO↑+8H2O
С помощью азотной кислоты получают взрывчатые вещества:
Тринитротолуол (тротил) получают с помощью смеси азотной и серной кислот:
Тринитроглицерин получают с помощью смеси азотной и серной кислот (серная кислота выступает в роли водоотнимающего средства):
Домашнее задание (выполните задания):
Напишите уравнения реакций взаимодействия азотной кислоты со следующими веществами в молекулярном и ионном виде:
a) Al2O3
б) Ba(OH)2
в) Na2S
1. Каковы специфические свойства концентрированной серной кислоты?
2. Каковы специфические свойства концентрированной азотной
кислоты?
Выполненное домашнее задание сфотографировать и прислать!
Октября 2021 г. (пятница)
Дисциплина: Химия
Группа: № 78
Урок №17
Литература: Рудзитис Г. Е. Химия. 11 класс: учеб. для общеобразоват. организаций с прил. на электрон. носителе базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 2014. – 224 с.
Материалы урока:
Повторить теоретический материал стр. 117-119
Тема: Соединения неметаллов в природе.
Задание: Написать тему (тема прилагается), выучить, ответить на вопросы.
Цель: Рассмотретьсоединения неметаллов в природе. Изучить химические свойства кислотных и основных оксидов.
Обучающие: обобщить, систематизировать и скорректировать знания, умения и навыки учащихся по вопросам, касающихся строения, свойств и применения неметаллов и их соединений.
Развивающие: способствовать развитию навыков самостоятельной познавательной деятельности, умений сравнительного анализа, логического мышления, действий в нестандартной ситуации.
Воспитательные: способствовать формированию и развитию личностных качеств, ответственности за свою работу, уверенности в своих знаниях.
Для многих простых веществ неметаллов известно по нескольку аллотропных модификаций, различающихся по своим физическим свойствам, как например, простые вещества, образуемые углеродом -- графит, алмаз, карбин, фуллерены.
Для кислорода характерны две аллотропные модификации – кислород и озон.
Например, кислород, как и озон является газом, но кислород бесцветный, а озон имеет сине-голубую окраску. Кислород не имеет запаха, а озон имеет резкий запах.Озон образуется при электрических разрядах, при окислении смолистых органических веществ, при действии ультрафиолетовых лучей на кислород.
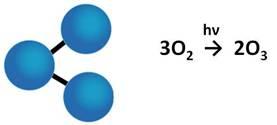
Поэтому озон содержится в воздухе после грозы, в сосновых лесах, на морском побережье.


А в лаборатории озон получают в специальных приборах – озонаторах.
Озон – более сильный окислитель, чем кислород, поэтому его используют при отбеливании тканей, дезодорировании жиров и масел, обеззараживании воздуха и воды.
Кроме этого, на высоте 20-25 км озон образует озоновый слой, который задерживает ультрафиолетовые лучи.
Озон относят к переменным составляющим воздуха. Ещё Лавуазье в восемнадцатом веке установил, что воздух представляет собой смесь газов. Поэтому в настоящее время различают постоянные, переменные и случайные составные части воздуха.
Постоянные составные части воздуха – это азот, кислород и благородные газы. К переменным составным частям воздуха относят углекислый газ, водяные пары, озон. А к случайным составным частям воздуха относят пыль, различных микроорганизмов и различные другие газы.
Запомните, что молярная масса воздуха – 29 г/моль. Воздух просто необходим для дыхания и фотосинтеза, участвует в процессах разрушения горных пород и почвообразовании.
Простые вещества неметаллы существенно различаются и по химической активности. Так, элементы VIII A группы – гелий, неон, аргон – образуют практически инертные вещества.
Наиболее химически активными неметаллами являются галогены и кислород. Сера, фосфор, а особенно углерод и кремний, вступают в химические реакции, как правило, только при повышенных температурах.
В химических реакциях неметаллы, кроме фтора, могут проявлять как окислительные, так и восстановительные свойства.
Окислительные свойства неметаллов проявляются при их взаимодействии с металлами и водородом. В образующихся соединениях атомы неметаллов проявляют отрицательные степени окисления.
Домашнее задание (выполните тест):
1. Какие из перечисленных химических элементов относятся к неметаллам?
а) Al б) N в) Cu г) C
2. Какие из указанных неметаллов образуют двухатомные молекулы?
а) сера б) водород в) кислород
г) углерод д) бром
3. Какие из указанных соединений образуют водородные соединения типа ЭН3?
а) сера б) фосфор в) углерод г) бром
4. Какой из указанных оксидов образует кислоту типа Н2ЭО3?
а) CO2 б) N2O5 в) SO3 г) CO д) SO2
5. Какие из приведенных неметаллов образуют высший оксид типа Э2О5?
а) сера б) углерод в) азот
г) фосфор д) фтор
6.Какой из указанных неметаллов является самым сильным окислителем?
а) сера б) кислород в) азот
г) фтор д) йод
Выполненное домашнее задание сфотографировать и прислать!