РЕФЕРАТ
По дисциплине: Физика
На тему:Газы и тепловые машины.Идеальный газ.Силы Ван дер-Вальса.
Выполнил: студент 1-го курса,
дневного отделения, 108 группа
факультет агрономии и биотехнологии,
Манаев М.Д
Проверил: Лёвкин. А.П.
Москва 2015
Оглавление
Закон идеального газа. 3
Первое начало термодинамики. Адиабатический процесс. 6
Второе начало термодинамики. 7
Принцип действия тепловых двигателей. 8
Двигатель Карно и его КПД. 12
Уравнение Ван-дер-Ваальса. 16
Список литературы: 18
Закон идеального газа.
Экспериментальный:
 Основными параметрами газа
Основными параметрами газа
являются температура, давление и объём. Объем газа существенно зависит от
давления и температуры газа. Поэтому необходимо найти соотношение между
объемом, давлением и температурой газа. Такое соотношение называется
уравнением состояния.
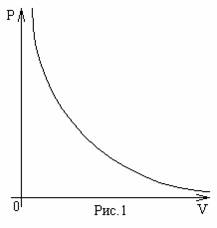
Экспериментально было обнаружено, что для данного количества газа в хорошем
приближении выполняется соотношение: при постоянной температуре объем газа
обратно пропорционален приложенному к нему давлению (рис.1):
V~1/P, при T=const.
 Например, если давление,
Например, если давление,
действующее на газ, увеличится вдвое, то объем уменьшится до половины
первоначального. Это соотношение известно как закон Бойля
(1627-1691)-Мариотта(1620-1684), его можно записать и так:
PV=const.
Это означает, что при изменении одной из величин, другая также изменится,
причем так, что их произведение останется постоянным.
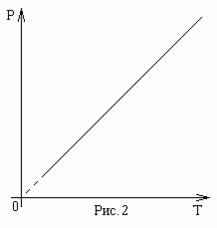
Зависимость объема от температуры (рис.2) была открыта Ж. Гей-Люссаком. Он
обнаружил, что при постоянном давлении объем данного количества газа прямо
пропорционален температуре:
V~T, при Р=const.
 График этой зависимости
График этой зависимости
проходит через начало координат и, соответственно, при 0К его объём станет
равный нулю, что очевидно не имеет физического смысла. Это привело к
предположению, что -2730С минимальная температура, которую можно
достичь.
Третий газовый закон, известный как закон Шарля, названный в честь Жака
Шарля (1746-1823). Этот закон гласит: при постоянном объеме давление газа
прямо пропорционально абсолютной температуре (рис.3):
Р~T, при V=const.
Хорошо известным примером действия этого закона является баллончик аэрозоля,
который взрывается в костре. Это происходит из-за резкого повышения
температуры при постоянном объеме.
Эти три закона являются экспериментальными, хорошо выполняющимися в реальных
газах только до тех пор, пока давление и плотность не очень велики, а
температура не слишком близка к температуре конденсации газа, поэтому слово
"закон" не очень подходит к этим свойствам газов, но оно стало общепринятым.
Газовые законы Бойля-Мариотта, Шарля и Гей-Люссака можно объединить в одно
более общее соотношение между объёмом, давлением и температурой, которое
справедливо для определенного количества газа:
PV~T
Это показывает, что при изменении одной из величин P, V или Т, изменятся и
две другие величины. Это выражение переходит в эти три закона, при принятии
одной величины постоянной.
Теперь следует учесть ещё одну величину, которую до сих пор мы считали
постоянной - количество этого газа. Экспериментально подтверждено, что: при
постоянных температуре и давлении замкнутый объём газа увеличивается прямо
пропорционально массе этого газа:
PV~mT
Эта зависимость связывает все основные величины газа. Если ввести в эту
пропорциональность коэффициент пропорциональности, то мы получим равенство.
Однако опыты показывают, что в разных газах этот коэффициент разный, поэтому
вместо массы m вводят количество вещества n (число молей).
В результате получаем:
| PV=nRT | (1) |
, где n - число молей, а R - коэффициент пропорциональности. Величина R
называется универсальной газовой постоянной. На сегодняшний день самое
точное значение этой величины равно:
R=8,31441 ± 0,00026 Дж/Моль
Равенство (1) называют уравнением состояния идеального газа или законом
идеального газа.
Число Авогадро; закон идеального газа на молекулярном уровне:
То, что постоянная R имеет одно и то же значение для всех газов, представляет
собой великолепное отражение простоты природы. Это впервые, хотя и в несколько
другой форме, осознал итальянец Амедео Авогадро (1776-1856). Он опытным путём
установил, что равные объёмы объемы газа при одинаковых давлении и
температуре содержат одинаковое число молекул. Во-первых: из уравнения (1)
видно, что если различные газы содержат равное число молей, имеют одинаковые
давления и температуры, то при условии постоянного R они занимают равные
объёмы. Во-вторых: число молекул в одном моле для всех газов одинаково, что
непосредственно следует из определения моля. Поэтому мы можем утверждать, что
величина R постоянна для всех газов.
Число молекул в одном моле называется числом Авогадро NA. В
настоящее время установлено, что число Авогадро равно:
NA=(6,022045±0,000031)·10-23 моль-1
Поскольку общее число молекул N газа равно числу молекул в одном моле,
умноженному на число молей (N=nNA), закон идеального газа можно
переписать следующим образом:
PV=nRT=N/NART
или
| PV=NkT | (2) |
, где k называется постоянной Больцмана и имеет значение равное:
k= R/NA=(1,380662±0,000044) ·10-23 Дж/К
Первое начало термодинамики. Адиабатический процесс.
Внутренняя энергия газа - это сумма кинетической и потенциальной энергии всех
молекул этого газа. Очевидно, что внутренняя энергия газа должна
увеличиваться либо за счет совершения над газом работы, либо путем сообщения
ему некоторого количества теплоты. И наоборот, если газ совершает работу над
внешними телами или тепловой поток направлен из газовой системы, то энергия
этой системы должна уменьшаться.
В результате опытов Джоуля (как и многих других) был сформулирован закон,
согласно которому изменение внутренней энергии (DU) замкнутой системы можно
записать в следующем виде:
| (DU)=Q- W | (3) |
, где Q-количество теплоты, сообщенное системе, а W-работа совершаемая системой.
Выражение (3) известно как первое начало термодинамики. Поскольку
теплота Q и работа W выражают способы передачи энергии в систему или из неё,
внутренняя энергия изменяется в соответствии с ними. Таким образом первое
начало термодинамики является попросту формулировкой закона сохранения энергии.
Уравнение (3) применимо как к замкнутым системам, так и к не замкнутым, если
учесть изменение энергии вследствие изменения количества вещества в данной
системе.
При переходе системы из одного состояния в другое (1 в 2) количество теплоты
Q, сообщённое системе, и работа W, совершённая системой, зависят от
конкретного процесса (или пути), в котором участвовала система. И для разных
процессов эти величины различны, даже если начальные и конечные состояния
системы одинаковы. Однако эксперименты показали, что при одинаковых начальном
и конечном состояниях разность Q-W одинакова для всех процессов, переводящих
систему из одного состояния в другое.
Адиабатическим называется процесс, при котором от системы не отбирается и
не сообщается энергии. Такой процесс может происходить, если система
изолирована или протекает столь быстро, что теплообмен практически не
происходит. Примером процесса, очень близкого к адиабатическому, является
расширение газов в двигателях внутреннего сгорания.
При медленном адиабатическом расширении из уравнения (3) следует (так как Q=0
(по определению адиабатического процесса)):
| (DU)=- W | (4) |
т.е. внутренняя энергия системы убывает, и поэтому температура понижается.
Соответственно при адиабатическом сжатии внутренняя энергия повышается и,
следовательно, температура повышается. Например, в двигателе Дизеля объем
быстро уменьшается, и поэтому температура увеличивается, а впрыскиваемая
смесь из-за высокой температуры воспламеняется.