(4) n(PbI2) = = 6,29*10-4моль C(PbI2) = 1,258*10-3 Ksp=4S3=7,96*10-9
26 билет
Растворы слабых электролитов. Константы ионизации слабых кислот и оснований (рКb). Химическая связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов. Характеристика р-элементов VI группы. Строение простых веществ, соединения с водородом, кислородом. Способность к образованию цепей и кратных связей.
(1) Вещества, распадающиеся в растворах или расплавах на ионы, называют электролитами, а процесс распада молекул на положительно и отрицательно заряженные ионы под действием растворителя называется электролитической диссоциацией. 

Слабые электролиты – вещества, молекулы которых в растворах ионизированы со степенью ионизации α < 3%. К ним относятся слабые кислоты и слабые основания.
Процесс ионизации обратим: 
Константа ионизации показывает отношение частиц, диссоциирующих в раствор, к количеству непродиссоциировавшего вещества.
Ионизация слабого электролита — процесс равновесный:СН3СООН <± Н+ + СН3СОСГ. В отличие от солей среди кислот и оснований есть и сильные и слабые электролиты. Большинство кислот и оснований — слабые электролиты. Ka и Kb зависят от природы, температуры, но не зависят от концентрации вещества.Ионизация электролитов, основность иили кислотность которых более 1 происходит ступенчато:
Диссоциация по каждой последующей ступени происходит в меньшей степени, чем по предыдущей. 
(2) Комплексные соед-я - молекулярные соединения, сочетание отдельных компонентов которых приводит к образованию сложных ионов или молекул, способных к самост. существованию, как в кристалле, так и в растворе.
МВС Связь в компл соединение образуется по дон-акц механизму, где донором выступает лиганд, а акцептором – комплексообразователь.Орбитали комплексообразователя гибридизированны. Связь при этом чисто ковалентная.
[BF4]- sp3 гибридизация и форма - тетраэдр.

МВС объясняет, но не прогнозирует св-ва координационных соединений.
Основные положения ТКП:
Механизм образования связей в корд.соед. объясняется чисто электростатическим взаимодействием между центральным ионом и лигандами.
Лиганды независимо от их реальной структуры представляют как точечные заряды. Связь между лигандом и комплексообразователем ионная.
Электронная конфигурация центр.иона рассматривается в рамках квантовохимических представлений.
ТКП приложима для описания хим.связи корд.соед. исключительно d- и f-элементов.
Схема расщепления энергетических уровней центрального атома под действием электростатического поля лиганда.
Различие в энергии двух уровней Eeg - Et2g=∆(∆0,∆T) называется энергией расщепления кристаллическим полем или просто расщеплением.
Энергия расщепления определяется и геометрической конфигурацией комплексного иона. Так энергия расщепления в тетраэдрическом комплексе ниже в сравнении с октаэдрическим. ∆T ≈ 4/9∆0
Факторы, определяющие энергию расщепления: степень окисления центр.атома, тип d-орбитали(3d,4d,5d), природу лиганда.
Энергия расщепления возрастает с увеличением степени окисления комплексообразователя. В этом случае лиганды располагаются ближе к центральному иону энергия взаимод. их с d-орбиталями возрастает. При переходе от 3d-> 5d энергия расщепления возрастает, т.к d-орбитали с большим главным квантовым числом имеют более вытянутую форму и активнее взаимодействуют с лигандами. Зависимость энергии расщепления от природы лиганда сложна, и учесть все факторы сложно. Характеристикой энергии расщепления кристаллическим полем определенного лиганда является его положение в спектрохимическом ряде:
(сил)CO>CN->>NO2->NH3> H2O >F->HO->Cl->Br->I-(слаб)
(3) Кислород — самый распространенный элемент. Его массовая доля в земной коре составляет 47,4 %. Ввиду высокой активности и большого содержания в земной коре кислород определяет формы существования других элементов периодической системы в виде оксидов, сульфатов, карбонатов. Объемная доля кислорода в земной атмосфере 21 % кислорода (массовая доля 23 %). Большое количество кислорода содержится в гидросфере (вода морей и океанов). Как простое вещество кислород существует в виде двух аллотропных модификаций: молекулярного кислорода 02 и озона Оз. В промышленности кислород получают фракционной перегонкой жидкого воздуха. Особо чистый кислород получают электролизом воды, в которую для увеличения электрической проводимости добавляют сульфат натрия, щелочь или серную кислоту. Оксидами называются бинарные соединения кислорода, в которых кислород имеет степень окисления -II. Оксиды по химическим свойствам разделяются на солеобразующие и несолеобразующие. Солеобразующие оксиды в зависимости от характера связи делятся на основные, амфотерные и кислотные. В основных оксидах связь преимущественно ионная, в кислотных — ковалентная. В подгруппах s- и p-элементов с возрастанием порядкового номера элемента увеличивается ионность связи, что приводит к усилению основных свойств оксидов. В периоде с возрастанием порядкового номера элемента увеличивается степень ковалентности связи в оксидах и усиливаются их кислотные свойства. Например, характер оксидов p-элементов группы V меняется следующим образом: N2O3 и Р2О3 — кислотные, AS2O3 и Sb2Оз — амфотерные, Вi2Оз — основной оксид.
Оксиды элементов третьего периода Na20, MgO проявляют основные свойства, AI2O3 — амфотерные, Si02, Р2О5, SO3, CI2O7 — кислотные. С возрастанием степени окисления элемента связь в оксиде становится более ковалентной и, следовательно, должны усиливаться кислотные свойства. Например, Sb2O5 имеет более кислотный характер, чем Sb203.
d-Элементы в низших степенях окисления образуют основные оксиды, а в высших — кислотные. Например, МnО, СгО — основные, Мn02, Сг20з — амфотерные, Мn2О7, СгОз — кислотные оксиды. Серу получают из самородных руд или окислением H2S, а также восстановлением S02. Для очистки от примесей серу перегоняют и осаждают в виде мелкого порошка — «серного цвета». Селен и теллур получают при переработке сульфидных руд, в которых они содержатся в виде примесей, а также из анодных шламов, остающихся после электролитической очистки меди. Сера на холоду сравнительно инертна, а при нагревании легко реагирует с галогенами, кислородом, водородом, металлами. По химическим свойствам селен и теллур являются аналогами серы. Они устойчивы на воздухе, легко взаимодействуют с галогенами, при нагревании образуют с кислородом диоксиды, Э02, со многими металлами — селениды и теллуриды. С водородом, как и сера, реагирует только селен. Усиление металлических свойств в ряду S, Se, Те проявляется в том, что теллур медленно реагирует с водой в обычных условиях с выделением водорода: Те + 2Н20 = Те02 + 2Н2 Селен реагирует при нагревании. В ряду S, Se, Те усиливается восстановительная способность и уменьшается окислительная. Молекула H2S имеет угловое строение, угол HSH= 92°. В обычных условиях сульфид водорода — бесцветный токсичный газ с резким запахом.
Сульфид водорода — сильный восстановитель, сгорает с образованием серы или диоксида серы, а в растворах окисляется до серы или сульфат-иона:
В ряду H2S, H2Se, Н2Те температуры кипения и плавления закономерно увеличиваются. Это можно объяснить усилением межмолекулярного взаимодействия вследствие увеличения радиуса атома элемента и увеличением поляризуемости молекул. Аномально высокие температуры кипения и плавления воды обусловлены ассоциацией молекул за счет водородных связей. Кислотные свойства в ряду Н20, H2S, H2Se, Н2Те увеличиваются, что связано с увеличением поляризуемости связи Э-Н. S02 — бесцветный газ с резким запахом, хорошо растворим в воде. Диоксиды селена и теллура — кристаллические вещества, а диоксид серы — газ. В ряду S02, Se02, Те02 кислотные свойства уменьшаются. Если S02 и Se02 хорошо растворимы в Н20 и щелочах, то практически не растворимый в воде Те02 взаимодействует с растворами щелочей и сильных кислот. В ряду гидроксидов H2S03, H2Se03, Н2Те03 кислотные свойства уменьшаются. Теллуристая кислота амфотерна. В отличие от соединений S(IV) производные Se(IV) и Te(IV) проявляют в большей степени окислительные свойства, чем восстановительные: Н2Э03 + 2H2S03 = 2H2S04 + Э + Н20, где Э = Se, Те H2Se03 + 2S02 + Н20 = 2H2S04 + Se
(4) Ksp=S2 S=1.26*10-5моль/л S=1.26*10-5моль/л*253=318*10-5г/л
27 билет
Окислительно-восстановительные процессы. Окислительно-восстановительные свойства веществ. Влияние различных факторов на характер и глубину протекания окислительно-восстановительных процессов. Необратимый гидролиз. Совместный гидролиз. Хлор. Химические свойства. Соединения с металлами, водородом. Кислоты хлора. Биологическая роль хлора.
(1) Окислительно-восстановительные реакции - это реакции, протекающие с изменением степеней окисления1 одного или нескольких элементов, входящих в состав реагирующих веществ: Zn + 2НС1 —» Н2 + ZnCl2 Окислительно-восстановительные реакции обусловлены процессами переноса электронов от восстановителя к окислителю. Окисление - процесс отдачи электронов. Окисление приводит к повышению степени окисления элемента: Восстановление - процесс присоединения электронов. Восстановление приводит к понижению степени окисления элемента: Окислитель — вещество, в молекулу которого входит элемент, присоединяющий электроны. Восстановитель - вещество, в молекулу которого входит элемент, отдающий электроны. Окислительно-восстановительная реакция - это единый процесс окисления — восстановления. Не существует отдельных процессов окисления или восстановления. В результате окислительно-восстановительного процесса окислитель становится потенциальным восстановителем, а восстановитель - потенциальным окислителем. Влияние среды на окислительно-восстановительные процессы Влияние среды на протекание окислительно-восстановительных процессов определяется в соответствии с принципом Ле Шателье.:Повышение кислотности среды активирует реакцию, протекающую с участием ионов водорода. Повышение щелочности среды активирует реакции, протекающие с участием гидроксвд-ионов.. Реакции тормозятся ионами водорода и гидроксид-ионами в том случае, когда последние являются продуктами реакции. В любой окислительно-восстановительной реакции принимают участие окислитель и восстановитель. Кроме того, в реакционной массе находятся продукты их взаимодействия — новый окислитель и новый восстановитель. NaOCl + Pb(N03): + Н20 = РbO2 + 2HN03 + NaCl Окислитель и его восстановленная форма, восстановитель и его окисленная форма образуют две сопряженные пары:. Окислителем в окислительно-восстановительных реакциях выступает только окисленная форма, восстановителем - восстановленная форма. В рассмотренной выше реакции окислителем является гипохлорит-ион ОСl (окисленная форма по отношению к Cl), восстановитель - РЬ“ (восстановленная форма по отношению к РbO2). Таким образом, в любой окислительно-восстановительной реакции участвуют, как минимум, две окислительно-восстановительные пары. Условием необходимым и достаточным для определения направления окислительно-восстановительного процесса является выделение среди реагентов окислителя и восстановителя.
(2) Гидролиз-обменное взаимодействие между ионами соли и водой/Необратимый гидролиз известен только для некоторых солей — Cr2S3, A12S3 и др. В воде эти соли полностью разлагаются:Cr,S3 + 6Н0Н -> 2Сг(0Н)3 + 3H2S.
К числу особых случаев гидролиза следует отнести и совместный гидролиз. Совместный гидролиз возможен в растворе двух или более солей. Условием для протекания этого типа гидролиза является гидролиз одной соли по катиону, а второй — по аниону:
А” + НОН НА + ОН", Ме+ + НОН МеОН + Н\
Образующиеся гидроксид-ионы и ионы водорода выводятся из сферы реакции в виде молекулы воды.
Этот тип — тип необратимого гидролиза. Он характерен для солей металлов со степенями окисления +3 и +2 (Fe3+, Ст3+. Си2*, Zn2+ и др.). Природа продуктов гидролиза определяется природой их солей. В случае солей металлов со степенями окисления +3 продуктами реакции является слабые основания и кислота:
CrCl3 + 3Na2C03 + 6Н20 -> 2Сг(ОН)3 + Н2С03 + 6NaCI
2А1С13 + 3Na2S + 6 Н20 = 2А1(ОН)3 + 6NaCl + 3H2S.
Если соль образована металлами со степенями окисления +2, то один из продуктов реакции — основная соль:
2CuC12 + 2Na2C03 + Н20 = (Cu0H)2C03 + СО, + 2NaCl.
(3) Cl 1s22s2p63s2p5
Хлор проявляет степени окисления от -I до VII, что обусловлено наличием d-подуровня в атомах.
Хлор йод имеет положительные степени окисления в соединениях с
кислородом (оксиды, кислородосодержащие кислоты и их соли), азотом (хлорамины и др.)
и в межгалоидных соединениях. Хлор содержится в виде солей в воде морей и океанов.
Получение электролиз концентрированного раствора NaCl. В лаборатории хлор получают окислением соляной кислоты различными окислителями 4НС1 + Мп02 = С12 + МпС12 + 2Н20 хлор — газ. Свободный хлор -сильный окислитель.Взаимодействуют с металлами и большинством неметаллов, кроме углерода, азота и кислорода: 2Р + 5С12= 2РС15
Хлор с водородом в обычных условиях реагирует медленно, а при нагревании или освещении — со взрывом. Хлор при растворении взаимодействует с водой Г2 + Н2О нг + нго
Водный раствор хлора – хлорная вода. Хлорид водорода получают также из простых веществ: Н2 + С12 = 2НСl. Хлорид водорода хорошо растворяются в воде. Водный р-р НС1— сильная к-та. HClO – слабый электролит. НСlО существует только в разбавленных растворах и неустойчива. Так, в растворе хлорноватистой кислоты параллельно протекают следующие процессы: НС10 = НС1 + О (на свету) 2НСЮ = С120 + НгО (в присутствии водоотнимающих средств) ЗНСЮ = 2НС1 + НСЮз (при нагревании). Соединения галогенов со степенью окисления I во всех средах проявляют сильные окислительные свойства, например: HClO + Н2О2 = О2 + НС1 + Н20 Хлор в степени окисления III образует хлористую кислоту НСl02, Хлористая кислота слабая неустойчивая, существует только в разбавленных растворах. Хлористая кислота обладает сильными окисл. свойствами. Хлорноватая кислота существует только в растворе. Получить можно из солей Ва(С103)2 + H2S04 = BaS04 + 2НС103 . Хлорная к-та самая сильная из всех кислот. Получают ее электролитически из НС1, а также отгонкой в вакууме при 16 °С из смеси перхлората калия и серной кислоты: 2КС104 + H2SO4 = 2НС104 + K2SO4 Безводная хлорная кислота — подвижная, дымящая на воздухе жидкость, при нагревании разлагается со взрывом: 4НС104 = 4С102 + 302 + 2Н20 При взаимодействии с оксидом фосфора(5) образует оксид хлора(7) (хлорный ангидрид):
4НС104 + Р4О10 = 2С1207 + 4НР03
Хлорная кислота, как окислитель, гораздо менее активна, чем другие кислоты хлора и в растворах практически не проявляет окислительных свойств. Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов в виде соединений. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия
(4) Ksp=S2 S=1.26*10-5моль/л S=1.26*10-5моль/л*253=318*10-5г/л
Билет
Окислительно-восстановительные равновесие в водных растворах. направление окислительно-восстановительных реакций. Уравнение Нернста.
Молекулярность и порядок реакции. Понятие о механизмах химических реакций.
Ртуть. Соединения ртути (I) и (II). Соединения с аммиаком.Соли. Применение соединений ртути в медицине.
(1) Приведем пример полуреакции: 2Fe3+ + 2e– D 2Fe2+ Sn2+ - 2e– D Sn4+ 2Fe3+ + Sn2+ D 2Fe2+ + Sn4+
В данном случае взаимодействуют между собой две сопряженные окислительно-восстановительные пары Fe3+/Fe2+ и Sn4+/ Sn2+. сущность любой реально протекающей окислительно-восстановительной реакции заключается в том, что окислитель одной пары взаимодействует с восстановителем другой пары, в результате чего образуются продукты этого взаимодействия суммарное окислительно-восстановительное равновесие всегда смещено в сторону той реакции, при которой более сильный окислитель взаимодействует с более сильным восстановителем. В окислительно-восстановительных реакциях переносимой частицей является электрон, не способный существовать в водном растворе, поэтому количественные соотношения, описывающие окислительно-восстановительные равновесия, никогда не содержат "концентрацию" электрона. электрон (электроны) переходят от восстановителя к окислителю не через раствор, а в результате непосредственного контакта частиц. В окислительно-восстановительных равновесиях в водных растворах сила окислителей и восстановителей количественно характеризуется стандартным электродным потенциалом окислительно-восстановительной пары относительно условно выбранной системы - нормального водородного электрода, а для условий, отличающихся от стандартных - величиной электродного потенциала, рассчитанного с помощью уравнения Нернста.

где Е – реальный (равновесный) окислительно-восстановительный потенциал данной пары, В; E0 – стандартный окислительно-восстановительный потенциал, В; аок и авос – активности окисленной и восстановленной форм, моль/л; R – универсальная газовая постоянная, равная 8,314 Дж/К.моль; Т – абсолютная температура, К; F – число Фарадея, равное 96500 Кл/моль; z – число электронов, участвующих в полуреакции; а и в – стехиометрические коэффициенты.
(2)Для характеристики механизма реакции вводится новое понятие новое понятие молекулярности реакции. Молекулярность реакции – это число молекул, принимающих участие в элементарном акте химического взаимодействия. Химический процесс превращения реагентов в продукты реакции состоит из множества последовательных актов химического взаимодействия.
Схему, указывающую эту последовательность, называют механизмом реакции.
По молекулярности различают моно- и бимолекулярные реакции. Что касается тримолекулярных реакций, то они крайне редки, поскольку вероятность столкновения в какой-то точке реакционного пространства трех молекул, отвечающих указанным ранее критериям, крайне низка. Реакции, в которых участвуют три или более молекул, протекают как правило, по схеме:
А+В+С=Q первая стадия реакции А+В=Р вторая стадия реакции Р+С=Q То есть в данном случае имеет место последовательность бимолекулярных процессов. Мономолекулярными, как правило, являются реакции разложения: HOCl=HCl+1/2О2 Для иллюстрации понятия «механизм реакции» рассмотрим цепную реакцию хлорирования метана: СН4+Cl=CH3Cl+HCl (общая схема). Схема механизма реакции: I стадия Cl2 => 2Cl II стадия CH4+Cl => CH3+HCl III стадия CH3+Cl2 =>CH3Cl+Cl Представленная схема хлорирования метана показывает, что процесс хлорирования протекает по радикальному механизму.
(3)Ртуть окисляется медленно. Ртуть не вытесняет водород из растворов кислот и щелочей. Ртуть легко растворяется в азотной кислоте:Hg + 4HN03 = Hg(N03)2 + 2N02T + 2H20 При избытке ртути происходит окисление до солей Hg(I): 6Hg + 8HN03 = 3Hg2(N03)2 + 2NOT + 4H20 Сплавы ртути — амальгамы — обычно жидкие или тестообразные, получают, растирая металл со ртутью при комнатной температуре или небольшом нагревании. Гидроксиды ртути не получены в свободном виде, так как разлагаются с отщеплением воды из-за сильного поляризующего действия катионов ртути на гидроксид- ионы: Hg(N03)2 + 2NaOH = HgO + 2Н20 + 2NaN03 Hg2(N03)2 + 2NaOH = Hg20 + H20 + 2NaN03 Основные свойства оксидов ртути выражены слабо. Малорастворимые соли ртути (HgS, Hg2Cl2 и т. д.) гидролизу практически не подвергаются. Сулема HgCl2, являясь слабым электролитом, гидролизована в малой степени, а нитраты ртути в водных растворах сильно гидролизованы и образуют малорастворимые оксосоли, так как основные соли, подобно гидроксидам ртути, неустойчивы: 2Hg2+ + Н20 + 2 NO3 = Hg20(N03)2 + 2Н+ 2Н^+ + Н20 +2NO3 = Hg40(N03)2 + 2Н+ Приготовление растворов нитратов ртути для предотвращения гидролиза ведут в присутствии азотной кислоты. Растворы солей ртути, HgCl2 и особенно Hg(CN)2, неэлектропроводны, так как соли не являются электролитами вследствие высокой степени ковалентности связей Hg-Cl и Hg-CN. Соединения ртути(П) проявляют свойства окислителя:2HgCl2 + S02 +2Н20 = Hg2Cl2 + H2SO4 + 2НС1 Соли ртути(1) характеризуются окислительно-восстановительной двойственностью: Hg2(N03)2 + 4HN03 = 2Hg(N03)2 +2N02t +2H20 Hg2Cl2 + SnCl2 = SnCl4 + 2Hg Комплексные ионы [Hg(NH3)4]2+ можно получить только для сульфата и перхлората ртути. При действии аммиака на раствор HgCb в избытке хлорида аммония образуется «плавкий белый преципитат» состава [Hg(NH3)2]Cl2. Избыток NH4CI необходим для предотвращения процесса разложения: [Hg(NH3)2]Cl2 NH4CI + [H2NHgCl] H2NHgCl — «неплавкий белый преципитат», амидохлорид ртути(П), имеет линейное полимерное строение.
(4) 2IO3+12H+ +10e = I2 +6H2O z=5 т.к 1 ион а не 2. M(1/z)=42.8 C(1/z)= ρ* ω*1000/M(1/z)=1.2л
29 билетКвантово-механическая модель атома водорода. Квантовые числа.Гидролиз. Основные типы гидролиза. Реакция среды в растворах кислых солей. Мышьяк. Оксиды, гидроксиды, сульфиды, галогениды, Арсин.
(1)Современные квантово-механические представления о строении электронной оболочки атома исходят из того, что движение электрона в атоме нельзя описать определенной траекторией. Можно рассматривать лишь некоторый объем пространства. В котором находится электрон. Поскольку электрон обладает одновременно свойствами частицы и волны, то подходом к объяснению строения электронной оболочки может быть как корпускулярная, так и волновая теория; обе они приводят к одинаковому наглядному представлению, сформулированному как орбитальная модель атома.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90%-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90%-ой плотности заряда электрона (как волны).
Собственной характеристикой каждого электрона в атоме является спин. Два электрона, находящиеся в одной атомной орбитали, различаются по спину.
В квантовой механике каждая атомная орбиталь определяется тремя квантовыми числами.
Главное квантовое число n – может принимать целочисленные значения от 1 до ¥. В Периодической системе элементов максимальному значению главного квантового числа соответствует номер периода.
Орбитальное квантовое число l – определяем орбитальный момент количества движения (импульс) электрона, точное значение его энергии и форму орбитали. Может принимать значения 0,1,2,3,…(n-1). Орбитальное квантовое число определяет форму атомной орбитали. При l=0 это сфера, при l=1 – объемная восьмерка (гантель), при l =2 четырехлепестковая розетка.
Магнитное квантовое число ml определяет возможные значения проекции орбитального момента количества движения электрона на фиксированное направление в пространстве (например ось Z) движение электрона вокруг ядра можно сравнить с движением тока по замкнутому контуру. Магнитное квантовое число определяет ориентацию орбитального углового момента относительно некоторого фиксированного направления. Орбитальному квантовому числу l =0 отвечает единственное значение магнитного квантового числа ml =0. Эти значения l и ml характеризуют все s –орбитали, которые имеют форму сферы. Так как в этом случае магнитное квантовое число принимает только одно значение, то каждый s подуровень состоит только из одной орбитали. Рассмотрим р-подуровень. При l =1 орбитали имеют форму гантелей, магнитное квантовое число принимает следующие значения ml = -1, 0, +1. Следовательно, р-подуровень состоит из трех атомных орбиталей, которые располагаются вдоль осей координат, их обозначают рx, рy, рz
(2)
Гидролиз – обменные взаимодействия ионов и молекул с водой.
Два основных механизма:
Гидролиз по катиону.
Катионы связываются с гидратирующей их молекулой воды донорно-акцепторной связью, где донор - О, входящий в состав OH- и имеющий по две свободные эл. пары, а акцептор – катионы со свободными квантовыми ячейками.

Гидролиз по аниону.
Анионы связываются с молекулами воды водородной связью. Сильное воздействие аниона может привести к отрыву протона, и водородная связь становится ковалентной.
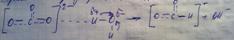
Соли, образованные катионами сильных оснований и анионами сильных кислот гидролизу не подвергаются ввиду малого поляризующего действия частиц на молекулы воды, небольших зарядов и радиусов.
Соли, образованные сильным основанием и слабой кислотой гидролизуются по аниону. Среда раствора щелочная.
NaCN+H20->HCN+NaOH
Если анион многозаряден, гидролиз протекает ступенчато.
Na2CO3+H20->NaHCO3+NaOH
NaHCO3+H2O->NaOH+H2CO3
Соли, образованные слабым основанием и сильной кислотой гидролизуются по катиону. Среда раствора кислая.
NH4Cl+H2O->NH4OH+HCl
Если катион многозаряден, гидролиз ступенчатый.
CuCl+H2O->(CuOH)Cl+HCl
Соль образована слабым основанием и слабой кислотой.
pH среды определяется по силе образовавшихся основания и кислоты. Растворы таких солей слабокислые или слабощелочные.
а) Катион и анион однозарядны.
CH3COONH4+H2O->CH3COOH+NH4OH
б) Катион однозаряден, анион многозарядный + наоборот.
Гидролиз протекает ступенчато, но каждая следующая стадия выражена в меньшей степени, чем предыдущая.
I. (NH4)2CO3+H2O->NH4OH+NH4HCO3
II. NH4CO3+H2O->NH4OH+H2CO3
K1>K2
в) Многозарядные катион и анион – необратимый гидролиз (соли, не существующие в растворе – соли Fe, Cr в СО +3 и др).
Fe2S3+6H20->2Fe(OH)3+3H2S
Совместный гидролиз – это гидролиз, протекающий при одновременном присутствии в растворе солей с противоположным характером гидролиза: одна – по катиону, др. – по аниону.
2CuCl2+2Na2CO3+H20->2NaCl+(CuOH)2CO3+CO2
Механизм совместного гидролиза:
Cu(2+)+HOH->CuOH(+)+H(+)
CO3(2-)+HOH->HCO3(-)+OH(-)
--------равновесие
Другой пример совместного гидролиза:
2FeCl3+3Na2S+6H2O->2Fe(OH)3+3H2S+6NaCl
(3)В природе мышьяк встречается в виде сульфидов сульфидов (AS2S3 — аурипигмент, AS4S4 — реальгар), а так же в виде примесей в других минералах. В свободном состоянии мышьяк, получают окислительно-восстановительным обжигом: 2AS2S3 + 902 = 2AS2O3 + 6SO2 (окислительный обжиг); AS2O3 + ЗС = 2As + ЗСО (восстановительный обжиг). В обычных условиях металлические модификации мышьяка устойчивы по отношению к кислороду и воде. При сгорании образуют оксиды Э2О3. Мышьяк проявляет неметаллические свойства, образуя соединения анионного типа: 3As + 5HN03 + 2Н20 = 3H3As04 + 5NO 2As + 3H2S04 = As203 + 3S02 + Н20, где AS2O3 представляет собой обезвоженную форму мышьяковистой кислоты (мышьяковистый ангидрид). Соединение мышьяка с металлами — арсениды — получают при непосредственном взаимодействии: ЗСа + 2As =Ca3As2 С большинством металлов мышьяк образует соединения металлического типа, а со щелочными и щелочноземельными металлами — соединения с ионной связью. При действии на эти соединения водой или кислотой выделяются газообразные водородные соединения — арсин: Na3As + НС1 = 3NaCl + AsН3, Арсин получают также восстановлением любых соединений мышьяка цинком в кислой среде. Арсин сильный восстановитель: AsH3 + 8HN03 = H3As04 + 8NO2 + 4Н20 В отличие от аммиака и фосфина он не проявляет основных свойств. Качественной реакцией на мышьяк является проба Марша: восстановление мышьяка из любого его соединения до арсина цинком, 4Zn + Na3As04 + 11НС1 = AsH3 + 4ZnCl2 + 3NaCl + 4H20 и дальнейшее разложение его при нагревании до металлического мышьяка: 2AsH3 = As + ЗН2 Гидроксид мышьяка(Ш) проявляет амфотерные свойства с преобладанием кислотных (мышьяковистая кислота). Для мышьяка степень окисления(5) устойчива, поэтому и мышьяковая кислота и арсенаты очень слабые окислители. При взаимодействии арсената натрия с концентрированной соляной кислотой протекает обменная реакция:Na3As04 + 8НС1 = AsC15 + 3NaCl + 4Н20 AsC 15 в кислотной среде устойчив Сульфид мышьяка(Ш), получают непосредственным взаимодействием простых веществ или действием сульфида водорода в кислотной среде на соответствующие соли:2Э + 3S = Э2S3 2Na3As03 + 3H2S + 6HC1 = As2S3 + 6NaCl + 6H20 Сульфиды мышьяка(5) 2Na3As04 + 5H2S + 6НС1 = As2S5 + 6NaCl + 8H20 Сульфид мышьяка -тиоангидрид, взаимодействуют с основными сульфидами, образуя тиосоли: Э2S3 + 3Na2S = 2Na3ЭS3